化学反应N2+3H2 2NH3的能量变化如下图所示,该反应的热化学方程式是( )
2NH3的能量变化如下图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g)  2NH3(l) ⊿H =2(a—b—c)kJ·mol-1 2NH3(l) ⊿H =2(a—b—c)kJ·mol-1 |
B.N2(g)+3H2(g)  2NH3(g) ⊿H =2(b—a)kJ·mol-1 2NH3(g) ⊿H =2(b—a)kJ·mol-1 |
C.1/2N2(g)+3/2H2(g)  NH3(l)⊿H = (b+c—a)kJ·mol-1 NH3(l)⊿H = (b+c—a)kJ·mol-1 |
D.1/2N2(g)+3/2H2(g)  NH3(g)⊿H = (a+b)kJ·mol-1 NH3(g)⊿H = (a+b)kJ·mol-1 |
接触室里装一个热交换器,其主要目的是()
| A.冷却反应后的混合气体,使SO3凝华后析出 |
| B.给催化剂加热 |
| C.把反应放出的热量传递给需要预热的反应混合气体 |
| D.降低接触室的温度,以免温度过高烧坏设备 |
形成酸雨的主要原因是()
| A.未经处理的工业废水任意排放 |
| B.大气中二氧化碳含量增多 |
| C.工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属 |
| D.汽车排放的尾气 |
向BaCl2溶液中通入SO2至饱和,此过程看不到现象;再向溶液中加入一种物质,溶液变浑浊。加入的这种物质不可能是()
| A.FeCl3溶液 | B.AlCl3溶液 | C.Na2S溶液 | D.AgNO3溶液 |
关于1 mol·L-1的硫酸溶液的下列叙述,不正确的是()
| A.1 L该溶液中含溶质98 g |
| B.从10 mL该溶液中取出5 mL后,剩余溶液浓度仍为1 mol·L-1 |
| C.将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中,充分混合就可配得该浓度的硫酸溶液 |
| D.该浓度的硫酸具有酸的通性,但不具有强氧化性 |
“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用,下列反应不符合这一理念的是()
| A.消除硝酸工业尾气的污染 NO+NO2+2NaOH  2NaNO2+H2O 2NaNO2+H2O |
| B.工业上制CuSO4 2Cu+O2 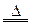 2CuO CuO+H2SO4 2CuO CuO+H2SO4 CuSO4+H2O CuSO4+H2O |
| C.乙炔水化法制乙醛 CH 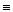 CH+H2O CH+H2O CH3CHO CH3CHO |
| D.消除硫酸厂尾气 |
SO2+2NH3+H2O (NH4)2SO3
(NH4)2SO3