下列实验操作不能达到其对应目的的是
| 序号 |
实验内容 |
实验目的 |
| A. |
向盛有10滴0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol/L Na2S溶液 |
证明AgCl沉淀能转化为溶解度更小的Ag2S沉淀 |
| B. |
向2 mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2mL己烷中加入3滴KMnO4酸性溶液,振荡 |
证明与苯环相连的甲基易被氧化 |
| C. |
向Na2SiO3溶液中通入CO2 |
证明碳酸的酸性比硅酸强 |
| D. |
在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜并加热 |
验证淀粉已水解 |
下列说法中正确的是
| A.汽油燃烧时将全部的化学能转化为热能 |
| B.向饱和AgCl溶液中加入盐酸,Ksp变大 |
| C.若存在简单阴离子R2-,则R一定属于VIA族 |
| D.最外层电子数少的金属元素,一定比最外层电子数多的金属元素活泼性强 |
已知有机物A的结构简式为 ,可发生硝化反应,则产生的一硝基化合物可能有
,可发生硝化反应,则产生的一硝基化合物可能有
| A.4种 | B.5种 | C.6种 | D.7种 |
下列有关表述正确的是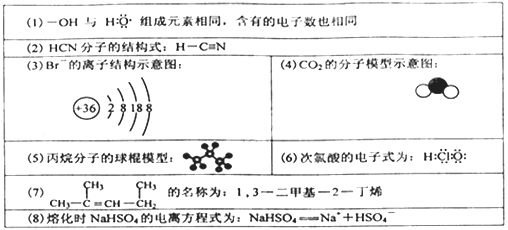
| A.(1)(2)(4)(6) | B.(1)(2)(5)(8) |
| C.(1)(4)(5)(8) | D.(2)(3)(5)(7) |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
下列操作不能用于检验NH3的是
| A.气体使湿润的酚酞试液变红 |
| B.气体能使湿润的红色石蕊试纸变蓝 |
| C.气体与蘸有浓H2SO4的玻璃棒靠近 |
| D.气体与蘸有浓盐酸的玻璃棒靠近 |