常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L CH3COOH溶液所得滴
定曲线如图。下列说法不正确的是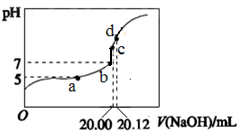
| A.a点所示溶液中:c(Na+)=c(CH3COOH) + c(CH3COO-) |
| B.b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
| C.d点所示溶液中:c(Na+) >c(CH3COO-) >c(OH-) >c(H+) |
| D.滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) >c(H+)> c(Na+)>c(OH-) |
反应3A(g)+B(g)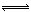 2C(g)+2D(g),在不同条件下的反应速率分别为:
2C(g)+2D(g),在不同条件下的反应速率分别为:
①VA=0.6mol·L-1·s-1,②VB=0.45mol·L-1·s-1,③VC=0.4mol·L-1·s-1,
④VD=0.45mol·L-1·s-1,则此反应在不同条件下进行最快的是
| A.① | B.②④ | C.② | D.④ |
决定化学反应速率的主要因素是( )
| A.参加反应的物质本身的性质 | B.催化剂 |
| C.温度、压强以及反应物的接触面 | D.反应物的浓度 |
如图所示为普通锌锰电池(即干电池)的组成和结构示意图,其中MnO2的作用是吸收正极放出的H2,下列说法正确的是( )
| A.锌是正极,MnO2是负极 | B.锌是负极,MnO2是正极 |
| C.锌是正极,石墨棒是负极 | D.锌是负极,石墨棒是正极 |
右图为一原电池装置,其中X、Y为两电极。对此装置的下列说法中正确的是( )
| A.若两电极都是金属,则它们的活动性顺序为:X>Y |
| B.外电路的电流方向是:X→外电路→Y |
| C.若两电极分别为锌棒和石墨棒,则X为石墨 |
| D.Y极上发生的是氧化反应 |
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生。则四种金属活动性顺序由强到弱的正确顺序为()
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |