氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知:
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K .(填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。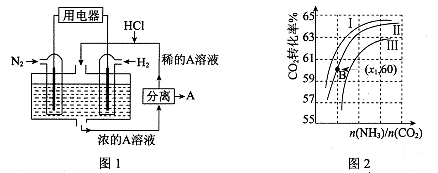
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比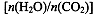 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
制取纯净的氯化铜晶体(CuCl2·2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2。
II.对I中所得到的溶液按下列步骤进行提纯。
已知:
氢氧化物开 始沉淀时的pH 始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ |
1.9 |
3.2 |
| Cu2+ |
4.7 |
6.7 |
试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是 。(填序号)
。(填序号)
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加紧入的物质Y是 。
。
②写出沉淀Z在水中的沉淀溶解平衡方程式:。
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2·2H2O),应采取的措施是。
(4)①某同学利用反应:Cu+2H+===Cu2 ++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为。(填“原电池”或“电解池”)
++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为。(填“原电池”或“电解池”)
②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。
(5)已知一些难溶物的浓度积常数如下表:
| 物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
| Ksp |
6.3×10-18 |
2.5×-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的除去它们。(选填序号)
①NaOH②FeS③Na2S
能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(I)十3O2(g)2CO2(g)+4H2O(g)△H= _1275.6 kJ·mol—1
②H2O(I) ="==" H2O(g)△H="+" 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式(2分).
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1
反应B:CO(g)+2H2(g) CH3OH(g)△H2
CH3OH(g)△H2
取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H1________0(填“>”、“<”或“=”)。
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是。
| A.升高温度 | B.增加CO2的量 |
| C.充入He,使体系总压强增大 | D.按原比例再充入CO2和H2 |
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO) ="0.5" mol·L—1,,则该温度下该反应的平衡常数为。
④.某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为______________________
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1∶1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。,则该反应的化学方程式为________。(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则
溶液中c(Na+)+c(H+)_____ c(NO3-)+c(OH-)(填写“>”“=”或“<”)
I. A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、 F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置,
(2)写出反应④的离子方程式。
(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的
pH7(填“>”、“<”或“=”),用离子方程式表示其原因:。
II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
(1)电解池阳极的电极反应分别是
①;②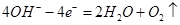 。
。
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是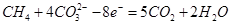 。
。
①正极的电极反应是。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是。
(3)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)L。
在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O  2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液, 溶液呈橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液, 溶液呈橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈_______色,平衡________。(填“向左移”或“向右移”,下同。)
(2)再加入过量稀H2SO4,则溶液呈_______色,平衡________。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡_______________,溶液颜色将__________。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)===CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。试判断此时的温度为_(3’)