W、X、Y、Z是短周期元素,其部分性质如下表
| W |
单质是淡黄色固体 |
| X |
在地壳中的含量居第二位 |
| Y |
原子最外层电子数是电子总数的2/3 |
| Z |
第三周期原子半径最小的金属 |
下列说法正确的是
A.气态氢化物的热稳定性:X>W
B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W
D.Z的氧化物中含有非极性共价键
长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是()
| A.第9列元素中有非金属元素 |
| B.只有第二列的元素原子最外层电子排布为ns2 |
| C.第四周期第8列元素是铁元素 |
| D.第15列元素原子的最外层电子排布为ns2np5 |
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2, 因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是()
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是()
A.CO与HbO2反应的平衡常数K=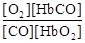 |
| B.人体吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 |
| D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 |
下列实验方案中不能实现:Fe+H2SO4=FeSO4+H2↑反应的是( )
| A.用导线将铁片和铜片连接后,放入一盛有稀 H2SO4溶液的烧杯中 |
| B.Cu片作阳极,铁片作阴极,电解一定量的H2SO4溶液 |
| C.Cu片作阴极,铁片作阳极,电解一定量的H2SO4溶液 |
| D.将铁片直接放入一盛有稀 H2SO4溶液的烧杯中 |
被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O ZnO+2MnO(OH)。下列说法正确的是 ( )
ZnO+2MnO(OH)。下列说法正确的是 ( )
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
| C.当65 g Zn完全溶解时,流经电极的电子1mol |
D.电池正极反应式为MnO2+e-+H2O MnO(OH)+OH- MnO(OH)+OH- |
将1 mL 0.1 mol·L-1的H2SO4溶液加入纯水中制成200 mL溶液,该溶液中由水自身电离产生的c(H+)最接近于()
| A.1×10-3 mol·L-1 | B.1×10-11 mol·L-1 | C.1×10-7 mol·L-1 | D.1×10-13 mol·L-1 |