下列条件下,离子能大量共存或者离子方程式正确的是
| A.pH=1的溶液中:Fe2+、ClO-、Na+、SO42- |
| B.在含较多Al3+的溶液中:K+、Cl-、HCO3- |
| C.NH4HSO4溶液与过量NaOH稀溶液反应:NH4+ +OH-=NH3·H2O |
| D.向小苏打溶液中加入NaOH固体:HCO3- + OH-=CO32- +H2O |
下列说法正确的是
| A.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| B.分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C.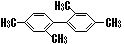 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D.1mol有机物 一定条件下能和7molNaOH反应。 一定条件下能和7molNaOH反应。 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA |
| B.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
| C.标准状况下,2.24L的CCl4中含有的C—Cl键数为0.4NA |
D.将CO2通过Na2O2使其增重a克时,反应中转移电子数为 |
下列说法正确的是
| A.塑化剂DEHP是指邻苯二甲酸二(2─乙基己)酯,对人体无害,可用作食品添加剂 |
| B.二氧化氮经过加压凝成无色液体为物理变化 |
| C.Na2O·SiO2是一种简单的硅酸盐,可溶于水 |
| D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
水的电离平衡曲线如右图所示,下列说法中,正确的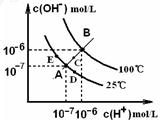
A.图中A、B、D三点处KW间的关系: B>A>D
B.100℃,向pH=2的稀硫酸中逐滴加入等体积pH=10的稀氨水,溶液中 c(NH4+)/c(NH3·H2O)减小,充分反应后,溶液到达B点
C.温度不变,在水中加入适量NH4Cl固体,可从A点变化到C点
D.加热浓缩A点所示溶液,可从A点变化到B点
下列说法中,不正确的是
| A.短周期元素中,最外层电子数是其电子层数两倍的元素共有3种 |
| B.第三周期元素的离子半径大小比较:S2->Cl->Na+>Mg2+>Al3+ |
| C.日本核电站释放出的131I、132I和133I属于同素异形体 |
| D.相同条件下,测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可比较C和S的非金属性强弱 |