下列实验操作和对应的现象、结论都正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
将饱和FeCl3溶液滴入沸水中 |
溶液变红褐色 |
有Fe(OH)3生成 |
| B |
用燃烧的镁条引燃铝热剂 |
剧烈反应 |
该反应是吸热反应 |
| C |
向溶液中滴加盐酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中含有SO42- |
| D |
用导线连接铜片和锌片后插进盐酸中 |
铜片上有气泡 |
铜片是原电池的正极 |
欲观察氢气燃烧的焰色,燃气导管口的材料最好的是()
| A.钠玻璃 | B.钾玻璃 | C.石英玻璃 | D.铜管 |
下列说法不正确的是()
| A.普通玻璃呈浅绿色是由于含有Fe2+ |
| B.坩埚、蒸发皿都属于陶瓷制品 |
| C.“唐三彩”是一种玻璃制品 |
| D.高温下CaSiO3比CaCO3稳定 |
下列说法正确的是()
| A.SiO2是酸性氧化物,它不溶于水也不溶于任何酸 |
| B.SiO2是制造玻璃的主要原料之一,它在常温下不与NaOH溶液反应 |
| C.因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 |
| D.CO2通入水玻璃中可得原硅酸 |
下列各组物质的主要成分都含有硅酸盐的是()
| A.石英玻璃和水玻璃 | B.普通玻璃和钢化玻璃 |
| C.瓷器和水晶 | D.普通玻璃和高温结构陶瓷(如人造刚玉) |
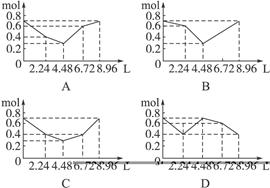
往含有0.2 mol NaOH和0.1 mol Ba(OH)2溶液中持续稳定地通入CO2气体,当通入气体为8.96 L(标准状况下)时立即停止。则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解和离子的水解忽略不计)()