(1)高温电解技术能高效实现CO2(g) + H2O(g) ="CO(g)" + H2(g) +O2(g) ,工作原理示意图如下: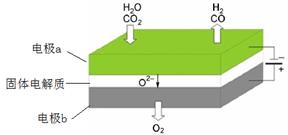
①电极b发生 (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是 。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: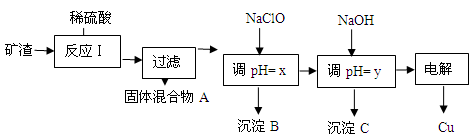
已知: Cu2O + 2H+ =" Cu" + Cu2+ + H2O
| 沉淀物 |
Cu(OH)2 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
5.4 |
4.0 |
1.1 |
5.8 |
| 沉淀完全pH |
6.7 |
5.2 |
3.2 |
8.8 |
①固体混合物A中的成分是 。
②反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是 。
④下列关于NaClO调pH的说法正确的是 (填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中加入l—2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe 、Br2谁的氧化性更强?
、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe >Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含(填化学式,下同)所致。
>Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含(填化学式,下同)所致。
②乙同学认为氧化性:Fe <Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含所致。
<Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含所致。
(3)设计实验并验证
丙同学为验证乙同学的观点。选用下列某些试剂设计两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a、酚酞试液 b、四氯化碳 c、无水酒精 d、硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 |
实验现象 |
|
| 方案1 |
||
| 方案2 |
(4)结论氧化性:Fe <Br2,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为。
<Br2,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为。
(5)实验后的思考
在2molFeBr2溶液中通入33.6L Cl2(标准状况),所发生的离子反应方程式为。
取一定质量的Fe 、Cu 混合物的粉末平均分成四等份,分别加入不同体积但同浓度的稀硝酸,实验中收集到的NO气体的体积及剩余固体的质量均记录在下表中(气体体积均在标准状况下测定)。
| 实验序号 |
① |
② |
③ |
④ |
| 稀硝酸体积 |
100mL |
200mL |
400mL |
|
| 剩余固体质量 |
17.2g |
8.00g |
固体恰好 全部溶解 |
0 |
| 气体体积 |
2.24L |
4.48L |
求:(1)计算稀硝酸的物质的量浓度;(2)填写上表中的空格。
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X的单质只有氧化性。
(1)写出实验室制取W2反应的离子方程式__________________________。
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质。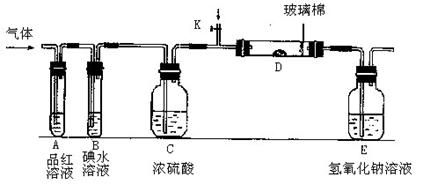
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)__________;若装置D中装的是铁粉,当通入W2时观察到的现象为_______________________;若装置D中装的是催化剂,当通入YX2时,打开K通入适量X2,化学反应方程式为__________________________________;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为__________________。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)________________,可以看到白色沉淀生成,其原因分别为_________________________________________________。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
(4)若由元素Y和X组成—2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,该反应的离子方程式为____________________________。
已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为:___________,它的共价键属于__________(填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为____________。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:____________ ;X与W形成的化合物与水反应时,水作的是__________(填:氧化剂、还原剂)。
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
(1)请根据甲同学的意图,连接相应的装置,接口顺序:
b接 , 接_______, 接a。
(2)U形管中所盛试剂的化学式为 。
(3)装置③中CCl4的作用是 。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在______之间(填装置序号)。瓶中可以放入 。