Ⅰ.龙胆酸甲酯是制取抗心律失常药物--------氟卡尼的中间体。
(1)龙胆酸甲酯的分子式为 ,它的含氧官能团名称为 。
(2)1mol龙胆酸甲酯与足量氢氧化钠溶液反应,消耗氢氧化钠的物质的量为
Ⅱ.已知:①x及其他几种有机物存在如下转化关系,C4H8为纯净物且含支链。② 回答以下问题:
回答以下问题:
(1)X的结构简式为 ,由A生成C4H8的反应类型为 ,B的核磁共振氢谱图中有 种吸收峰。
(2)写出下列转化的化学方程式:
(3)满足下列条件的龙胆酸的同分异构体有 种。
①能发生银镜反应; ②能使溶液显色; ③酯类。
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I称取样品1.500g。
步骤II将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察。
④滴定达到终点时,酚酞指示剂由色变成色。
(2)滴定结果如下表所示: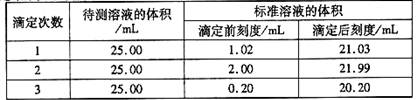
若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为
工业制备高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
①KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是______(填代号)。
a、84消毒液(NaClO溶液) b、双氧水 c、苯酚 d、75%酒精
②高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a、浓硝酸 b、硝酸银 c、氯水 d、烧碱
③上述流程中可以循环使用的物质有、(写化学式)。
④若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得mol KMnO4。
⑤该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号)。a、石灰石 b、稀HCl c、稀H2SO4 d、纯碱
⑥操作Ⅰ的名称是;操作Ⅱ根据KMnO4和K2CO3两物质在(填性质)上的差异,采用(填操作步骤)、趁热过滤得到KMnO4粗晶体。
(1)化学实验必须注意安全,下列做法存在安全隐患的是(选填序号)。
| A.氢气还原氧化铜实验中,先加热氧化铜后通氢气 |
| B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拨开橡皮塞并投入碎瓷片 |
| C.实验室做钠的实验时,余下的钠屑投入到废液缸中 |
| D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中 |
E.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
(2)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是;不溶于水,且密度比水小的是。
(3)一瓶无色气体,可能含有CH4和CH2==CH2,或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。
由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?,
。
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如右图所示。
(1)如果A是淡黄色固体,
①写出B、E的化学式:B 、E 。
②C→D的化学方程式为_____________________。
③将足量的物质C通过入BaCl2溶液中,下列说法正确的是___________(填字母序号)。
a.溶液没有明显变化
b.溶液中出现白色浑浊
c.若继续通入Cl2或NH3,溶液都出现白色浑浊
(2)如果A是无色气体:
D→E的化学方程式为 ;
E→C的离子方程式为 。
现有6种短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| W |
周期表中原子半径最小的元素 |
| U |
地壳中含量最多的金属元素 |
| R |
单质为空气的主要成分 |
| T |
M层上有6个电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):
(1)元素T的原子共有个电子;元素X的一种核素可测定文物年代,这种核素的
符号是。
(2)用电子式表示:
①气态化合物XR2_________________;
②元素W、R形成的10电子分子的形成过程______________________________。
(3)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热的反应 _____;
②元素U的单质与NaOH溶液反应_______________________________________。
(4)元素Z与元素T相比,非金属性较强的是,下列表述中能证明这一事实的
是(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)探寻物质的性质差异性是学习的重要方法之一。在T、X、Y、Z四种元素的最高价
氧化物的水化物中,化学性质明显不同于其他三种的是(用分子式表示),
理由是。