在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。已知:K(300℃)>K(350 ℃),则该反应正反应是 热反应。
(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v(O2)= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
用Fe与稀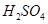 反应制取
反应制取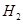 时,下列措施不能使
时,下列措施不能使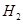 的生成速率加快的是( )
的生成速率加快的是( )
| A.加热 | B.不用稀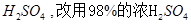 |
C.滴加少量的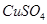 |
D.不用铁片,改用铁粉 |
右图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述错误的是()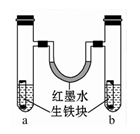
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe →Fe2++2e- |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g) C(g)+ D(g)已达到平衡状态()
C(g)+ D(g)已达到平衡状态()
①混合气体的压强;②混合气体的密度;③各气体物质的物质的量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量
| A.②③⑤ | B.①②③ | C.②③④⑤ | D.①③④⑤ |
汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g) N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是()
N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是()
| A.只要使用合理的催化剂及载体,就可完全清除NO和CO |
| B.该反应达到平衡时v(NO)正=v(CO)逆 |
| C.假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO) |
| D.使用性能好的催化剂可使反应的平衡常数增大 |
燃烧热是指一定条件下1 mol可燃物完全燃烧生成稳定的氧化物时放出的热量。已知热化学方程式:①CO(g)+1/2 O2(g)====CO2(g)ΔH =" -283.0" kJ·mol-1
②H2(g)+ 1/2O2(g)====H2O(g)ΔH =" -241.8" kJ·mol-1
则下列说法正确的是()
| A.由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)="===" CO2(g)+H2(g)ΔH =" -41.2" kJ·mol-1 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.H2(g)转变成H2O(g)的化学反应一定要释放能量 |
| D.根据②推知反应H2(g)+1/2O2(g)="===" H2O(l)ΔH > -241.8 kJ·mol-1 |