相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:
X2 (g+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热46.3 kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>0) |
下列叙述不正确的是
A.容器①中达到平衡时,Y2的转化率为50%
B.Q="27.78" kJ
C.若容器①体积改为1.0 L.则达平衡时放出的热量大于46.3 kJ
D.容器①、②中反应的平衡常数相等,K=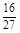
下列离子方程式正确的是( )
A.碳酸氢铵溶液与足量氢氧化钠溶液反应: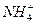 +OH-====NH3·H2O +OH-====NH3·H2O |
| B.Fe(OH)3与氢碘酸溶液混合:Fe(OH)3+3H+====Fe3++3H2O |
| C.电解精炼铜的阴极反应是:Cu2++2e-====Cu |
D.1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl等体积互相均匀混合:2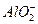 +5H+====Al(OH)3↓+Al3++H2O +5H+====Al(OH)3↓+Al3++H2O |
反应2FeCl3+H2S====2FeCl2+S↓+2HCl改写为离子方程式,正确的是( )
| A.2Fe3++S2-====2Fe2++S↓ | B.Fe3++H2S====Fe2++S↓+2H+ |
| C.2Fe3++H2S====Fe2++S↓+2H+ | D.2FeCl3+S2-====2FeCl2+S↓+2Cl- |
下列各组离子在强酸性无色溶液中共存的是( )
A.Na+K+ Cl- Cl- |
B.Ca2+ Cl- Cl- |
C.K+ Cu2+ Cl- Cl- |
D.Mg2+ Ca2+ Cl-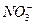 |
与离子方程式Fe3++3OH-====Fe(OH)3↓相对应的化学方程式是( )
| A.FeSO4+2NaOH====Fe(OH)2↓+Na2SO4 |
| B.2Fe(NO3)3+3Mg(OH)2====2Fe(OH)3↓+3Mg(NO3)2 |
| C.Fe2(SO4)3+3Ba(OH)2====2Fe(OH)3↓+3BaSO4↓ |
| D.Fe2(SO4)3+6NaOH====2Fe(OH)3↓+3Na2SO4 |
根据化学方程式:S(s)+O2(g)====SO2(g);ΔH="a" kJ·mol-1(a=-297.2),在下列说法中,不正确的是( )
| A.S(s)在O2(g)中燃烧的反应是放热反应 |
| B.S(g)+O2(g)====SO2(g);ΔH="b" kJ·mol-1,则a<b |
| C.在相同温度下,1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 |
| D.16 g固体硫在空气中充分燃烧,可放出148.6 kJ的热量 |