下列说法不正确的是
| A.乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 |
| B.乙酸乙醋在碱性条件下水解,属于皂化反应 |
| C.使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| D.道尔顿首次提出原子学说、汤姆生发现电子、卢瑟福确定原子核的存在,都为原子结构理论的发展作出了巨大贡献 |
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
| A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH )之和 )之和 |
硼化钒-空气电池是目前储电能力最高的电池,电池示意图如下图所示,该电池工作时的反应为:4 VB2+11O2===4B2O3+2V2O5,下列说法正确的是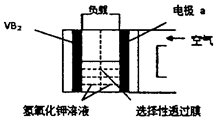
| A.电极a是电源负极 |
| B.溶液中的OH-向a极移动 |
| C.电子由VB2极经KOH溶液流向电极a |
| D.VB2极发生的电极反应为: |
2 VB2+22OH-===V2O5+2B2O3+11H2O+22e-
六种短周期元素A、B、C、D、E、F的原子序数依次增大, C和F同族,B、C、D、E的离子均具有相同的电子层结构,E在同周期元素中离子半径最小。A和B、C、F均能形成共价型化合物,A和B形成的化合物Y在水中呈碱性,D和F形成的化合物在水中呈中性。下列说法错误的是
A.B、D离子的半径大小是B>D
B.C的单质能将F的单质从EF3的溶液中置换出来
C.化合物AC的沸点比化合物AF的高
D.化合物AF与化合物Y可形成含有共价键的离子化合物
某酒的样品中检出了塑化剂邻苯二甲酸二丁酯,其结构简式如下图所示,该物质在一定条件下不能发生的反应类型是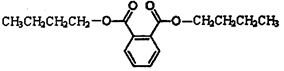
| A.与氢气的加成反应 |
| B.与氯气的取代反应 |
| C.与溴水的加成反应 |
| D.水解反应 |
下列现象或事实可用同一原理解释的是
| A.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化 |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| C.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色 |
| D.漂白粉和水玻璃长期暴露在空气中变质 |