葡萄糖是人类的营养素。在人体里,富氧条件下氧化生成二氧化碳和水;在缺氧时则生成一种有机酸A。已知:

回答下列问题:
(1)C和D′属于________(填编号,以下同)。
①同系物 ②同分异构体
③同类物质 ④同素异形体
(2)D′和E分别属于哪一类化合物:D′________,E________。
①多元醇 ②醛 ③不饱和羧酸 ④多元羧酸 ⑤酯
(3)写出结构简式:A ____________,F ________________,
H________。
(4)写出反应类型:Ⅰ________,Ⅱ________。
(5)写出A→E的化学方程式:_______________________。
以煤为主要原料可以制备乙二醇,相关工艺流程下:
(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式____________________
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是 ____(填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成分为CH4。)与C02反应制备合成气。已知:
则CH4与CO2生成合成气的热化学方程式为
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:
①草酸是二元弱酸,可以制备 (草酸氢钾),
(草酸氢钾), 溶液呈酸性,用化学平衡原理解释: 。
溶液呈酸性,用化学平衡原理解释: 。
②在一定的 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
A.
B.
C.
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的(填“正”或“负”)级,负极反应式为 。
某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 g NaHCO3固体的烧杯中加入10 mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10 mL 密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度T3。 得到表1的数据:表1
| T1/℃ |
T2/℃ |
T3/℃ |
|
| Na2CO3 |
23.3 |
20.0 |
23.7 |
| NaHCO3 |
18.5 |
20.0 |
20.8 |
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是 (用离子方程式表示)。
(2)根据试题后的附表判断:
步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解_________________。
(3)分析表1的数据得出:Na2CO3固体溶于水__________,NaHCO3固体溶于水__________(填“放热”或“吸热”)。
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中加入10 mL ,搅拌,测量温度为22.2℃。
(5)结合上述探究,下列说法正确的是______________。
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为____ _(用代数式表示)。
附表:溶解度表
| 温度 溶解度 |
10 ℃ |
20 ℃ |
30 ℃ |
40 ℃ |
| Na2CO3 |
12.5 g |
21.5 g |
39.7 g |
40.0 g |
| NaHCO3 |
8.1 g |
9.6 g |
11.1 g |
12.7 g |
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
① 已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO,PdCl2被还原成单质,反应的化学方程式为 ;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
① 负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为 (填“吸”或“放”)热反应;
②实验2中,平衡常数K= ;
③实验3跟实验2相比,改变的条件可能是 (答一种情况即可)
SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中生成HSO3-的离子方程式为 ;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: ;
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3−、NO2−,写出生成NO3−的离子方程式_____ 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。
①生成Ce4+的电极反应式为_____ 。
②生成Ce4+从电解槽的__________(填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2−的浓度为a g⋅L−1,要使1m3该溶液中的NO2−完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___ L。(用含a代数式表示,计算结果保留整数)
工业合成氨的反应为N2(g)+3H2(g)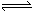 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应经过20分钟在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应经过20分钟在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为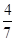 计算:
计算:
(1)H2在20分钟内的平均反应速率为 ;
(2)该条件下N2的平衡转化率为 ;(小数点后保留一位)
(3)该条件下反应2NH3(g)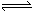 N2(g)+3H2(g)的平衡常数为 。(不带单位)
N2(g)+3H2(g)的平衡常数为 。(不带单位)