现有通式为(CH2O)n的六种有机物,性质如下:
①甲是无色有刺激性气味的气体,可以发生银镜反应;
②乙、丙、丁的相对分子质量均为甲的2倍,戊的相对分子质量是甲的3倍,己的相对分子质量是甲的6倍;
③乙、戊的水溶液可使紫色石蕊试液变红,还可以与乙醇在一定条件下酯化,乙和戊之间也能酯化;
④戊结构中含有—CH3,两分子戊可形成环状酯;
⑤丙不溶于水;丁、己两种物质的水溶液均呈中性;丙既能水解,又能发生银镜反应;丁能与钠反应放出H2,且能与新制Cu(OH)2悬浊液加热反应产生红色沉淀;己能发生银镜反应,它可由淀粉水解制得。
(1)推断各物质的结构,写出其结构简式。
甲________,乙________,丙________,
丁________,戊________,己________。
(2)甲~己中能与NaOH溶液反应的是________,(填序号,下同)能发生酯化反应的是________,能被H2还原为醇的是________,能发生银镜反应的是________。
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题: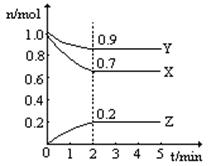
(1)该反应的化学方程式是;
(2)从开始至2min,NH3的平均反应速率是;
(3)用电子式表示X的形成过程___________________ __ __;
(4)第4分钟时下列叙述正确的是;
| A.该反应已停止 | B.该反应为可逆反应 |
| C.3v(H2)=2v(NH3) | D.c(H2):c(N2):c(NH3)=" 7" :9 :2 |
(5)若拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1mol N2与H2反应完全转化为NH3应_________热量(填“吸收”或“放出” )。
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间(秒)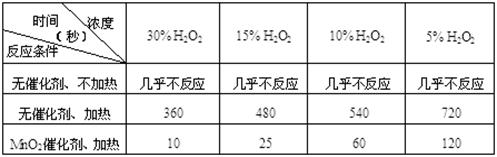
①研究小组在设计方案时,考虑了浓度、、等因素对过氧化氢分解速率的影响。
②上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下: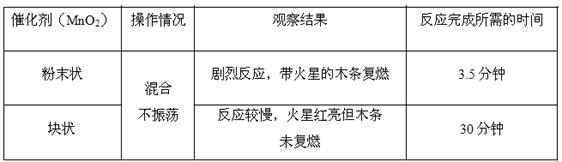
①写出H2O2发生的化学反应方程式。
②实验结果说明催化剂作用的大小与有关。
原电池是将能转化为能。其中,电子流出的一极是原电池的极,电子流入的一极是原电池的极,原电池的负极发生反应。
(共10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____________,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式______。
(4)用电子式表示元素④与⑥的化合物的形成过程:,该化合物属于(填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式,该化合物是由(填“极性”或“非极性”)键形成的。
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称________;B在周期表中的位置:第________周期,第________族;
(2)A、B形成的化合物的化学式________;
(3)C的元素符号________,C的最高价氧化物的化学式________;
(4)D的最高价氧化物对应的水化物的化学式________________。