常温下,0.1 mol·L-1HX的pH=1,0.1 mol·L-1CH3COOH的pH=2.9。下列说法不正确的是
| A.HX和CH3COOH均可抑制水的电离 |
| B.将HX与CH3COOH 各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)="0.2" mol·L-1 |
| C.将等物质的量浓度、等体积的HX与CH3COONa两溶液混合后所得溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+) |
| D.0.3mol·L-1的CH3COOK溶液:c(CH3COO-)+ c(CH3COOH)= c(K+) |
下列实验中,现象及得出的结论正确的是
| 实 验 |
现 象 |
结论 |
|
| A |
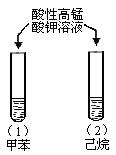 |
试管(1)中紫色褪去, 试管(2)中紫色未褪 |
苯环使甲基的活性增强 |
| B |
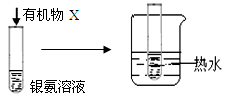 |
试管内壁有 银镜生成 |
有机物X中一定含有醛基 |
| C |
向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 |
未见砖红色沉淀 |
淀粉未水解 |
| D |
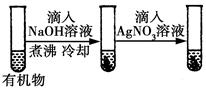 |
最后一只试管中有浅黄色沉淀 |
有机物中含有溴原子 |
下列说法正确的是
| A.人们常借助元素分析仪来确定有机化合物的组成 |
| B.有机化合物的核磁共振氢谱可以帮助我们确定物质中氢原子的种类 |
| C.根据对红外光谱的分析,可以初步判定该有机物中碳原子的种类 |
| D.用质谱法对有机物进行分析,可以初步判断该有机物中具有哪些基团 |
某物质结构简式如图所示,下列有关该物质的说法不正确的是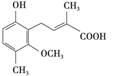
| A.该物质分子式为C13H16O4 |
| B.能与FeCl3溶液发生显色反应 |
| C.在一定条件下可发生加成、取代、消去反应 |
| D.1 mol该物质最多能与2mol NaOH反应 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| B.常温常压下,22.4 L CH4中含有的C—H键数为4NA |
| C.含0.2 mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA |
| D.lmol FeCl2与足量氯气反应时转移的电子数为2NA |