某化学探究小组的同学准备用碳酸钠溶液与石灰水反应来制取氢氧化钠。请你与他们一起踏上实验之旅。
(1)实验过程:①把石灰水加人盛有碳酸钠溶液的烧杯中充分搅拌,发生反应的化学方程式: 。
②过滤后,对无色滤液蒸发结晶,得到白色固体。
(2)猜想:得到的白色固体是纯氢氧化钠吗?三位同学分别作出以下猜想:
小玲:是纯净的氢氧化钠!
佳佳:可能还含有碳酸钠!
小强:也可能含有 。
(3)验证:我来验证佳佳的猜想。
| 实验操作 |
实验现象 |
实验结论 |
| 取少量白色固体配成溶液,加入足量 ① |
② |
③ |
下图所示的三个实验中,实验1说明二氧化碳具有的性质是
;
实验2瓶中发生反应的化学方程式为 ;
实验3中观察到的现象是 ;
大理石与稀盐酸反应的化学方程式为。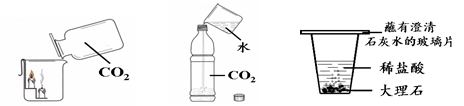
实验1实验2实验3
根据下图所示实验装置回答问题:
⑴小明同学选择A装置准备用高锰酸钾为原料制取一瓶纯净的氧气(不考虑水蒸气),他应选择的收集装置是(填字母),若要收集一瓶纯净的氧气应选择的收集装置
是(填字母)。
⑵小华同学想用过氧化氢溶液和二氧化锰为原料代替高锰酸钾制取一瓶较干燥氧气,她选择的发生装置是(填字母),理由是。 
⑶当过氧化氢接触到二氧化锰后,反应便立即开始,不能人为控制其速度和生成氧气的量。如果你稍改变所选择装置,便可控制其反应速度,请从右图的仪器中选择一种仪器更换小华同学选择的装置中一种仪器,以达到控制反应速度的目的,你选择的仪器是(填序号),它更换原装置中的(填名称)。你认为以上小明和小华制取氧气的方法中哪一种更好,,理由是
化学小组同学在加热二氧化锰样品时,发现有气泡产生(如图一所示),于是他们对这个异常现象进行了探究。
(1)对气体成分的探究:加热二氧化锰样品,用燃着的木条靠近试管口,木条熄灭。将气体通入澄清的石灰水,发现石灰水变浑浊,产生的气体是。
(2)对气体来源的探究:
【假设1】甲同学认为:该气体来自于试管中的空气,请你设计实验证明该假设不成立
| 实验步骤及现象 |
结论 |
| 假设不成立。 |
【假设2】乙同学认为:二氧化锰样品中可能混有炭粉,炭粉发生反应生成了该气体。他设计了如图二所示的实验进行研究,其中B装置的作用是检验A中反应是否完全,B中的试剂是,实验中观察到D处澄清石灰水变浑浊。他又用氮气代替空气(氮气不参与该实验中的任何反应),重复上述实验,发现D处澄清的石灰水也变浑浊。
结论:通过乙同学的实验证明,二氧化锰中混有炭粉,炭粉与 反应产生了这种气体。
请根据以下实验装置,回答问题:
 A B C D E
A B C D E
(1)写出图中标号仪器的名称:①,②。
(2)写出实验室用A装置制取氧气的符号表达式,收集氧气可选用C装置或装置,若选用C装置收集较纯净氧气的适宜时间是(填字母)
A.当导管口刚有气泡冒出时
B.当导管口停止冒出气泡时
C.当导管口有连续均匀气泡冒出时
某兴趣小组的同学在探究Al和Cu的活动性时,把铝片放入硫酸铜的水溶液中,无意中发现有较多气泡产生,于是激发了他们的探究欲望.
【提出问题】该气体是什么呢?
【猜想】甲同学认为可能是氧气;乙同学认为可能是氢气;
丙同学认为可能二氧化碳;丁同学认为可能是二氧化硫;
【操作分析】
铝片放入硫酸铜之前,应先用砂布将表面打磨光亮,理由是
【探究设计】
(1)闻该气体的气味,发现没有气味,排除了同学的猜想.
(2)从物质的组成角度考虑,又排除了同学的猜想.
(3)对余下的两种猜想进行了如下实验:
| 实验步骤 |
现象 |
结论 |
| 收集一试管气体,将带火星的木条伸入试管中 |
木条不复燃 |
|
| 发出轻微的爆鸣声,并产生淡蓝色火焰 |
该气体是氢气 |
【思维拓展】由以上探究实验可以推知,硫酸铜溶液中可能含有物质(填化学式)