图1是甲、乙两种物质的溶解度曲线,图2所示两个烧杯中各盛有20℃时上述两种物质的饱和溶液。请你通过分析,回答下列问题: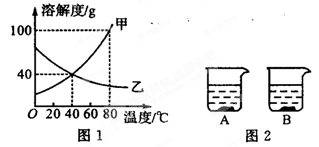
(1)溶解度随温度升高而增大的物质是 (填“甲”或“乙”);
(2)80℃时,100 g水中最多可溶解甲物质 g,该饱和溶液中溶质的质量分数为 。
(3)当温度由20℃升高至60℃时(不考虑水分蒸发),B烧杯中固体质量增加,则B烧杯溶液中的溶质是 (填“甲”或“乙”)。
(4)由图1分析,若分别将200 g甲、乙的饱和溶液从80℃降温到40℃,对所得溶液的叙述正确的是 (填序号)。
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙
(5)甲中混有少量乙,如果要提纯甲,分离的实验操作步骤主要有:①称量需提纯的固体混合物;②控制水量,配制成80℃左右的饱和溶液; ③降温至20℃后进行过滤,并用少量冷水洗涤过滤器中的固体2-3次;④取出固体,干燥、包装。
请回答:步骤③中,过滤后,需进行洗涤,目的是 。
不用热水而用冷水洗涤的原因是 。
(6)有同学做了以下实验,请仔细观察下图中实验过程和溶液的变化并回答问题。
在A、B、C 中Ca(OH)2 溶液的溶质质量分数的大小关系是 。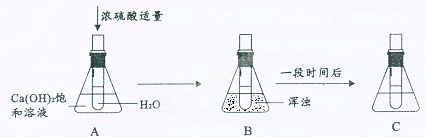
用化学符号填空
(1)植物光合作用需要的气体 (2)2个硝酸根离子
(3) 正2价的铜元素 (4)硫酸铝 ;
经过学习,你一定掌握了相关气体的制备方法。现有下列实验装置图,回答问题:
(1)指出上图中标号仪器的名称① ;② 。
(2)若用过氧化氢溶液与二氧化锰制取氧气,可选用的发生装置是______________。在加药品之前的操作是 。反应的文字表达式是 ;(书写文字表达式时,物质用化学式代替)该反应属于 反应(填一种反应类型)。二氧化锰是反应的 。
(3)若收集一瓶氧气,供硫粉在氧气中燃烧的实验使用,最好选用气体的收集装置中的 (填装置序号),理由是 。燃烧时,硫发出明亮的 色火焰,并放出热量;硫在氧气中燃烧反应的文字表达式为: 。(书写文字表达式时,物质用化学式代替)
(4)实验室常用无水醋酸钠和碱石灰两种固体混合物加热制取甲烷气体。甲烷的密度比空气密度小,极难溶于水,制取甲烷的发生装置是 ,收集装置可用 或 。
水是生命之源,人类的日常生活与工农业生产都离不开水。
(1)自然界的水会不断的蒸发,在水蒸发的过程中,下列说法正确的是(填字母序号,)________;
A.水分子不断运动
B.水分子之间间隔不变
C.水分子本身的体积变大
D.水分子可以保持水的物理性质
(2)通过对水电解实验的研究,人们认识到水是由_______ ______组成的。水电解反应的文字表达式为_____________________________。(书写文字表达式时,物质用化学式代替)
右图是水分子分解的示意图,请回答: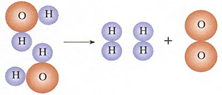
该变化中发生变化的微粒是______________;没有发生变化的微粒是______________________。
(3)某实验小组从湖中取了水样,观察到:水样呈淡黄色,有异味,水样浑浊,有固体小颗粒。他们进行了一系列的净化处理,请回答:
①向水样中加入明矾搅拌溶解,静置一段时间后,除去其中固体小颗粒,进行过滤操作,该操作过程中玻璃棒所起的作用是 。然后再向滤液中加入活性炭,利用其___________性除去水样中的颜色和异味,该过程属于___________(填“物理”或“化学”)变化。
②水样经上述净化处理后变为无色、无味、澄清的水,这种水是否为纯净物?__________,为什么? ___________________________。
(4)硬水会给生产、生活带来许多不便。鉴别硬水和软水的最简便方法是用_________________。生活中既能降低水的硬度,又能杀菌消毒的方法是 ,硬水在该过程中发生的化学反应之一是:
碳酸氢钙 碳酸钙+二氧化碳+水。根据以上信息推测:长期烧水的水壶内会有水垢,水垢中一定含有的物质是____________。
碳酸钙+二氧化碳+水。根据以上信息推测:长期烧水的水壶内会有水垢,水垢中一定含有的物质是____________。
(5)使用含磷洗衣粉的生活污水会造成水中藻类大量繁殖,使水质恶化。这里的“磷”是指 (请用序号填空)。
A.元素 B.原子 C.离子 D.分子
(6)有些科学家预言:“世界上最后一滴水就是人类的眼泪”。这句话警示我们应树立保护水资源的意识:一是节约用水,二是防止水体污染。请你举一例节约用水的做法 。
(合理答案均可)。
下表是元素周期表的一部分,请你根据下表回答问题:
| 3 Li 锂 6.941 |
4Be[来铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟[来 19.00 |
10 Ne 氖 20.18 |
| 11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 29.95 |
(1)根据上表回答问题
①钠的相对原子质量是 。
②上表中,金属元素有 种。
(2)图甲是某元素在元素周期表中的部分信息,图乙是该元素的一种粒子结构示意图。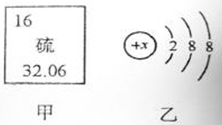
①该元素的原子的核电荷数为 ,该原子的最外层电子数为 。
②图乙所示粒子的符号为 。
用化学符号表示:
①3个氧原子 ②+3价的铝元素 ③2个钠离子
④2个二氧化硫分子 ⑤氯化亚铁 ⑥碳酸钠
⑦说出下列符号中“2”的意义
O2 ;
Mg2+ 。