右图是某同学设计的原电池装置,下列叙述中正确的是
| A.电极Ⅰ上发生氧化反应,作原电池的正极 |
| B.反应一段时间后,电极Ⅱ的电极质量增大 |
| C.该原电池的总反应为:2Fe3++Cu= Cu2++2Fe2+ |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
在下述条件下,一定能大量共存的离子组是:()
| A.无色透明的水溶液中:K+、Ba2+、I-、MnO4- | |
| B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ | |
| C.c(HCO3-)=0.1mol·L-1的溶液中:Na+、K+、CO32-、Br- |
D.强碱性溶液中:ClO-、S2-、HSO3-、Na+ |
在25℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中,进行电解,通电一段时间后,阴极逸出amol气体,同时有wg Na2SO4·10H2O晶体析出,若温度不变,剩余溶液的质量分数是( )
A.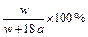 |
B.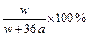 |
C.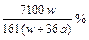 |
D.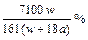 |
已知H2(g)+Br2(l)=2HBr(g);△H=-72KJ/mol,蒸发1mol Br2(l)需要吸收的能量为30KJ,其他的相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
| 1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
则表中a为( )
| A.404 | B.260 | C.200 | D.230 |
用惰性电极电解VmL某二价金属的硫酸盐溶液一段时间后,阴极有wmg金属析出,溶液的pH从6.5变为2.0(体积变 化可忽略不计)。析出金属的相对原子质量为 ( )
化可忽略不计)。析出金属的相对原子质量为 ( )
| A.100w/V | B.20 0w/V 0w/V |
C.2×10-5w/V | D.1×10-5w/V |
中央电视台《生活315:排毒基真能排毒吗》的节目中报道,一种名叫“排毒基强离子排毒仪”的产品正在市场上热销。该仪器像一个普通电动脚盆,使用时往注满水的盆中放入双脚,加一些精盐,通电启动仪器,过了一段时间,盆中开始出现灰绿色、红褐色的絮状物质。下列说法不正确的是()
| A.灰绿色、红褐色的絮状物质中含有Fe(OH)2和Fe(OH)3 |
B.此电动脚 盆仪器的电极全是用惰性电极材料制成的 盆仪器的电极全是用惰性电极材料制成的 |
| C.通电一段时间,没有刺激性气体产生 |
| D.此过程中涉及到的反应之一:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 |