随着电子工业的发展,电子垃圾的数量逐渐增多,对环境构成了极大的污染。某化学兴趣探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
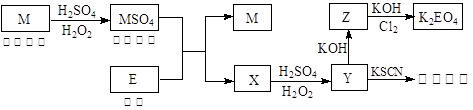
(1)写出Z与Cl2、KOH反应生成K2EO4的离子方程式: 。
(2)检验X中阳离子的方法和现象是 。
(3)如果各步转化无损失,M转化为MSO4消耗的H2O2与X转化为Y消耗的H2O2的用量之比为:
。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有 、 、 (填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。
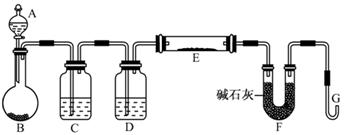
①如果去掉装置C,则测定的M的相对原子质量 (填写偏高、偏低、正常),装置D的作用 ;
②连接好装置并检验装置的气密性,检验气密性的方法是:
。
然后应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ? 在这两步之间还应进行的操作是 。
已知下图中H是无色液体,号称生命之源,B是空气中含量最多的物质,E是红棕色气体。
(1)C的化学式是。
(2)D和E都是大气污染物,两种物质相互转化的化学方程式分别是:
①D→E。
②E→D。
(3)E和H的反应中,氧化剂和还原剂的质量比是。
(4)C和F反应生成G的化学方程式是。
(1)下列两组无色溶液分别选用一种试剂鉴别,写出试剂的化学式。
①NaCl Na2CO3 Na2SiO3 Na2SO3试剂:
②(NH4)2SO4 NH4C1 Na2SO4 NaCl试剂:
(2)下列物质中含有少量杂质(括号内物质为杂质),用离子方程式表示除去杂质的原理
| 编号 |
物质 |
离子方程式 |
| ① |
NaHCO3(Na2CO3) |
|
| ②[ |
SiO2(CaCO3) |
|
| ③ |
Fe2O3(Al2O3) |
|
| ④ |
FeCl2(FeCl3) |
写出下列反应的化学方程式
(1)过氧化钠与二氧化碳:
(2)二氧化硫与氧气:
(3)铜与浓硫酸:(标出电子转移的方向和数目)
(12分) 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度(填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则(填“甲”或“乙”)判断正确。试剂X是。
A. Ba(OH)2溶液 B. BaCl2溶液 C. NaOH溶液 D. 澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则(填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言(填“甲”或“乙”)判断是错误的,理由是。
250C时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的计算结果(填具体数字):
c (HA)+c (A-)=mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7 (填>、<、=);
(5)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4AC.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列(填序号)