硫酸的产量是衡量一个国家化工水平的标志。2SO2(g) + O2(g)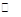 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
| |
甲 |
乙 |
丙 |
|
| 起始物质的量 |
n(SO2) / mol |
0.4 |
0.4 |
0.8 |
| n(O2) / mol |
0.24 |
0.48 |
0.48 |
|
| SO2的平衡转化率 |
80% |
α1 |
α2 |
|
下列判断中,正确的是( )
A.甲中反应的平衡常数大于乙 B.平衡时,SO2的转化率:α1<80%<α2
C.该温度下,乙中平衡常数值为400 D.平衡时,丙中c(SO3)是甲中的2倍
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A.2.5mol C
B.2 mol A、1 mol B和10 mol He(不参加反应)
C.1.5 mol B和1.5 mol C
D.2 mol A、3 mol B和3 mol C
已知:H2(g)+F2(g)= 2HF(g) ΔH= -27kJ/mol,下列说法正确的是( )
| A.2 L氟化氢气体分解成1 L氢气与1 L氟气吸收27 kJ热量 |
| B.1 mol 氢气与1 mol 氟气反应生成2 mol 液态氟化氢放出的热量小于27 kJ |
| C.在25℃、101kPa下,1 mol 氢气与1 mol 氟气的能量总和大于2 mol 氟化氢气体的能量 |
| D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出27 kJ 热量 |
在密闭容器中,一定量的混合气体发生反应:xA(g)+yB(g)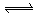 zC(g)
zC(g)
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.20mol/L。下列有关判断正确的是( )
| A.x+y>z |
| B.平衡向正反应方向移动 |
| C.B的转化率降低 |
| D.C的体积分数下降 |
已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g ) 2NH3 ( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为()
2NH3 ( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为()
| A.一定大于92.0 kJ | B.一定等于92.0 kJ | C.一定小于92.0 kJ | D.不能确定 |
影响活化分子的百分数的因素有()
①温度②浓度③压强④催化剂⑤接触面积
A①② B、①②③④ C、①④ D、②④