柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3=FeCO3↓+Na2SO4
FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Al3+ |
3.0 |
5.0 |
| Fe2+ |
5.8 |
8.8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。①铁粉的作用是 。
②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4溶液, ,得到FeSO4·7H2O晶体。
(12分)实验室用碳酸钠晶体配制1.00 mol·L-1的Na2CO3溶液80 mL,回答下列问题:
(1)本实验需称量碳酸钠晶体(Na2CO3·10H2O)的质量为 g。
(2)应选用 mL容量瓶。
(3)某同学将称量好的碳酸钠晶体用适量的蒸馏水在烧杯中溶解,冷却后,直接倒入经检查不漏水的容量瓶中,洗涤烧杯和玻璃棒各2~3次,洗涤液也移至容量瓶中,然后加水至距刻度线1~2 cm处,用胶头滴管加蒸馏水至刻度线,然后将溶液转入试剂瓶中。指出上述操作中的3个错误。
① ;
② ;
③ 。
(4)配制上述溶液,造成所配溶液浓度偏低的原因是 。
| A.称量碳酸钠晶体(Na2CO3·10H2O)的时间太长,且暴露在空气中 |
| B.向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 |
| C.定容时俯视刻度线 |
| D.洗涤液移至容量瓶中时洒出一部分 |
【化学——选修5:有机化学基础】某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):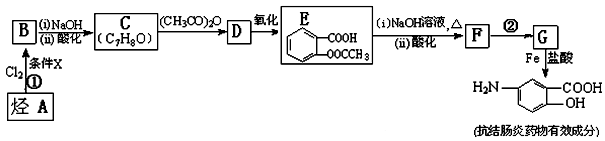
根据以上信息回答下列问题:
(1)烃A的结构简式是 。
(2)①的反应条件是 。②的反应类型是 。
(3)下列对抗结肠炎药物有效成分可能具有的性质推测正确的是: 。
| A.水溶性比苯酚好,密度比苯酚的大 | B.能发生消去反应 |
| C.能发生聚合反应 | D.既有酸性又有碱性 |
(4)E与足量NaOH溶液反应的化学方程式是 。
(5)写出符合下列条件的E的同分异构体的结构简式(任写三种): 。
a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)已知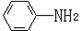 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物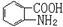 的合成路线 (仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)。
的合成路线 (仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)。
【化学——选修3:物质结构与性质】A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大。A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族。回答下列问题:
(1)A、B、C第一电离能由大到小的顺序为: (用元素符号表示)。
(2)B与C形成的二元化合物中,属于非极性分子的是: (填化学式);该分子中心原子的杂化类型为: 。
(3)A、C元素形成的常见含氧酸中,分子的中心原子的价层电子对数为4的酸是 ;(填化学式,下同)酸根呈平面三角形的酸是 。
(4)E和F形成的一种化合物的晶体结构如图所示,则该化合物的化学式为 ;F的配位数为 。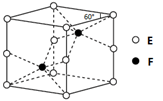
(5)D的离子可以形成多种配合物,由Dn+、Br-、C的最高价含氧酸根和A的简单氢化物形成的1:1:1:5的某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物的化学式为: ;n值为 ;Dn+的基态电子排布式为: 。
氮及氮的化合物在生产生活中有着重要的用途,NH3、HNO3等是重要化工产品。
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
① 2C + O2 → 2CO
② C + H2O(g) → CO + H2
③ CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:则表中x= m3。
| 气体 |
CO |
N2 |
CO2 |
H2 |
O2 |
| 体积(m3)(标准状况) |
x |
20 |
12 |
60 |
1.0 |
(2)汽车尾气会排放氮的氧化物污染环境。已知气缸中生成NO的反应为:
N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
(3)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)  2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH=________kJ·mol-1。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
(4)25℃时,电离平衡常数:
| 化学式 |
H2CO3 |
HClO |
H2C4H4O6(酒石酸) |
| 电离平衡常数 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
K1=9.1×10-4 K2=4.3×10-5 |
回答下列问题:
a.常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系不正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-) >c(ClO-) > c(H+)
C.c(Na+) ==" c(HClO)" +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)== c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)== c(OH-) + c(CO32-)
b.常温下,0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= (列出计算式)。
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g)ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
写出由磷酸钙矿制取白磷总的反应方程式____________。
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1 = 7.1×10−3 K2 = 6.3×10−8 K3 =4.2×10−13 lg7.1≈0.9 lg6.3≈0.8 lg4.2≈0.6) 。Na2HPO4溶液显碱性,若向其溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O= 20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。