已知下列反应:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O(Ⅰ);5Cl2+I2+6H2O=10HCl+2HIO3(Ⅱ)。下列说法正确的是 ( )。
| A.反应Ⅰ中HCl是氧化剂 |
| B.反应Ⅱ中Cl2发生氧化反应 |
| C.还原性:CoCl2>HCl>I2 |
| D.氧化性:Co2O3>Cl2>HIO3 |
已知反应2A(g) B(?)+ 2C(?)△H>0,满足如图所示的关系,则下列说法中正确的是
B(?)+ 2C(?)△H>0,满足如图所示的关系,则下列说法中正确的是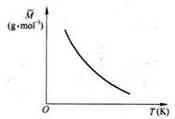
| A.B、C可能均为非气态 |
| B.若B是气态,则C一定也只能是气态 |
| C.若B为固态,则C一定为气态 |
| D.B、C可能均是气态 |
在高温下,反应2HBr(g) H2(g)+Br2(g)△H>0, 达到平衡,要使混合气体颜色加深,可采取的方法是
H2(g)+Br2(g)△H>0, 达到平衡,要使混合气体颜色加深,可采取的方法是
| A.减小压强 | B.缩小体积 | C.升高温度 | D.增大氢气浓度 |
下列各图是温度T(或压强P)对f反应2A(s) + 2B(g)  2C(g) + D(g)△H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
2C(g) + D(g)△H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
以NA代表阿伏加德罗常数的数值,则关于热化学方程式:
C2H2 ( g ) +5/2O2 ( g ) ==2CO2 ( g )+H2O ( l )△H = -1300kJ / mol的说法中,正确的是
| A.当10 NA个电子转移时,该反应放出1300kJ的能量 |
| B.当1 NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C.当2 NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D.当8 NA个碳氧共用电子对生成时,放出1300kJ的能量 |
反应aX(g)+bY(g) cZ(g), 在不同的温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示。下列判断不正确的是
cZ(g), 在不同的温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示。下列判断不正确的是
| A.T1<T2 | B.反应热△H<0 | C.P1>P2 | D.a+b>c |