某研究性学习小组就Na2O2的有关性质探究如下:向滴有酚酞的水中投入一定量的Na2O2,观察到先有大量气泡产生,溶液变红,过一会儿溶液又变为无色。
对上述实验中溶液变红,过一会儿又褪色的原因,甲、乙两同学提出了不同的解释:
甲同学认为是Na2O2与水反应放出氧气,氧气有氧化性,将酚酞氧化而使溶液褪色;
乙同学则认为是Na2O2与水反应时产生了H2O2,H2O2的强氧化性使酚酞褪色。
(1)乙同学设计了如下实验来证明自己的猜想是正确的:在滴有酚酞的氢氧化钠溶液中滴加3%的H2O2溶液并振荡。
①若乙同学的猜想正确,可观察到的现象是 。
②甲同学针对乙同学的上述验证实验提出还应增做实验才能更直接证明Na2O2与水反应生成了H2O2,甲同学提出要增加的实验是什么?
(2)试设计简单实验证明甲同学的解释是否正确(画出简易装置图,说明简要步骤)。
FeSO4·7H2O广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图。根据题意完成下列填空:
(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_____,浸泡后,用____(填操作方法)分离并洗涤铁屑。
(2)操作a为_______________。
(3)最后得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;
②____________________。
(4) FeSO4·7H2O是某些补血剂的主要成分,实验室要测定某补血剂中铁元素的含量。
I.方案一:可用KMn04溶液进行氧化还原滴定。在配制100mL 1.00 × 10 - 2 mol·L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___________(填仪器名称)。在配制过程中,下列说法正确的是____________(填序号字母)。
| A.KMnO4溶于水不放热,可以直接在容量瓶中溶解 |
| B.容量瓶洗涤后不需干燥即可直接用于实验 |
| C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平 |
| D.如果定容时加水超过刻度线必须毓配制 |
II.方案二:将FeSO4·7H2O最终转化为Fe2O3,测定质量变化,操作流程如下: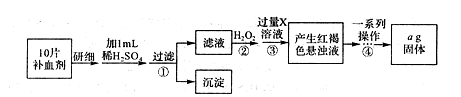
①步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量。
②假设实验过程中Fe无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示)。
③若步骤③加入X溶液的量不足,则最后测出每片补血剂含铁元素的质量将______(填“偏大,’.“偏小”或“不变”)。
为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
| 水解反应 |
平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ |
7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ |
3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ |
3.2 × 10-7 |
请回答:(1)稀硝酸和Cu反应的化学方程式为。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方案:。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
| 实验内容 |
实验现象 |
| 甲同学的实验方案 |
溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 |
无明显现象,pH没有明显变化。 |
①据实验现象写出发生反应的离子方程式:。
②导致实验过程中溶液pH略有上升的可能原因是。
③解释乙同学的实验现象。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:。
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下: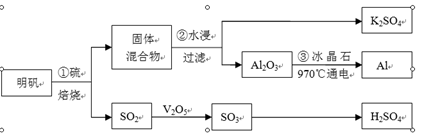
明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是。
(2)步骤②中,为提高浸出率,可采取的措施有。
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)从水浸后的滤液中得到K2SO4晶体的方法是。
(4)步骤③电解的化学方程式是,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为吨(列出计算表达式)。
由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下: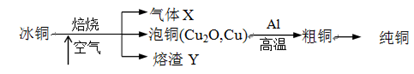
请回答下列问题:
(1)气体X是。
(2)某研究性学习小组用熔渣Y与CO反应来制取Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②装置C的作用是________________。
③在点燃D处的酒精灯前,应进行的操作是__________________。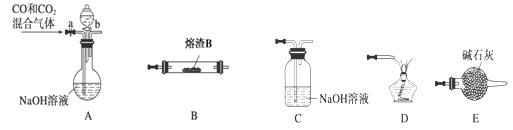
(3)熔渣Y中铁元素的价态有+2价和+3价,根据限选试剂,设计实验方案验证熔渣Y中有+2价铁元素存在,写出有关实验操作、预期现象与结论。
限选试剂: 3 mol·L-1H2SO4、6 mol·L-1HNO3、3% H2O2、0.01 mol·L-1KMnO4、20% KSCN。
。
(4)写出泡铜冶炼粗铜反应的化学方程式。
(5)根据限选材料画出用粗铜提炼纯铜的装置图,并进行必要的标注。
限选材料:FeSO4(aq)、CuSO4(aq)、粗铁、纯铁、粗铜、纯铜、烧杯、直流电源、导线。
(1)高温电解技术能高效实现CO2(g) + H2O(g) ="CO(g)" + H2(g) +O2(g),工作原理示意图如下: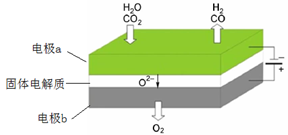
①电极b发生(填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: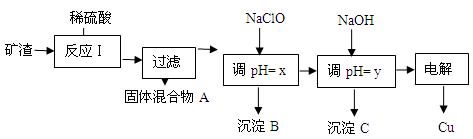
已知: Cu2O + 2H+=" Cu" + Cu2+ + H2O
| 沉淀物 |
Cu(OH)2 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
5.4 |
4.0 |
1.1 |
5.8 |
| 沉淀完全pH |
6.7 |
5.2 |
3.2 |
8.8 |
①固体混合物A中的成分是。
②反应Ⅰ完成后,铁元素的存在形式为。(填离子符号)
请写出生成该离子的离子方程式。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是。
④下列关于NaClO调pH的说法正确的是(填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为。