纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图。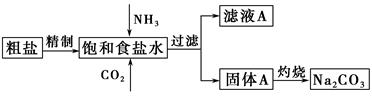
已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序是a→ → → →b(填字母编号)。
a.粗盐溶解,滤去沉渣
b.加入盐酸调pH
c.加入Ba(OH)2溶液
d.加入Na2CO3溶液
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是 。
(2)灼烧固体A制Na2CO3在 (填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是 。
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3使pH降低,反应的离子方程式为 。
(3)下图装置中常用于实验室制备CO2的是 (填字母编号);用b装置制备NH3,分液漏斗中盛放的试剂是 (填试剂名称),烧瓶内可加入的固体试剂是 (填试剂名称)。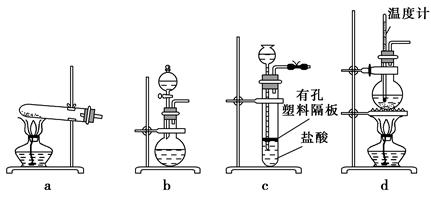
(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。(仪器自选)请把实验方案填全:
供选择的试剂:1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水
①称取m1g天然碱晶体样品,溶于适量蒸馏水中。
② 。
③ 。
④计算天然碱晶体中含Na2CO3的质量分数。
空气污染监测仪是根据SO 2 与Br 2 的定量反应测定空气中SO 2 的含量:SO 2 +Br 2 + 2H 2 O="=H" 2 SO 4 +2HBr,上述反应的溴,来自一个装满酸性KBr溶液的电解槽阳极上的氧化反应。电解槽的阴、阳极室是隔开的。当测空气中SO 2 的含量时,空气(经过除尘)以1.5×10 - 4 m 3·min - 1 的流速进入电解槽的阳极室,电流计显示每秒通过的电子是8.56×10 - 1 1mol时,此条件下能保持溴浓度恒定,并恰与SO 2 完全反应(设被测空气中不含与溴反应的物质)。
(1)写出监测过程中主要发生的化学反应方程式;_______________________。
(2)计算空气中SO 2 的含量(g·m - 3 空气)。
按下面的实验过程填空:
写出上述反应的化学方程式:
(1)______________________________________________;
(2)______________________________________________;
(3)______________________________________________。
人造纤维的原料是____________,合成纤维的原料是____________。
填空:
(1)图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL。如果刻度A为4,量筒中液体的体积是______________mL。
图Ⅰ图Ⅱ
(2)图Ⅱ表示50 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_______________。
A.是a mLB.是(50-a) mL
C.一定大于a mL D.一定大于(50-a) mL
下图是测定植物某一生命活动过程的装置,A瓶中的氢氧化钠的作用是______________,B瓶中的石灰水的作用是___________,D瓶中出现的现象是_____________。此实验说明植物具有_________性质。