新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成 。
(2)氯气能使湿润的红色布条退色。对于使湿润的红色布条退色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
| 提出问题 |
收集资料 |
提出假设 |
验证假设 |
得结论出 |
| 氯水中何种物质能使湿润的红色布条退色? |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
① ② ③ ④H2O使布条退色 |
①:实验①:把红色干布条放入充满氯气的集气瓶中,布条不退色 实实验②: ; 实验③:把红色布条放在水里,布条不退色 |
|
某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 |
铁的质量/g |
铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol·L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 |
0.10 |
片状 |
50 |
0.8 |
20 |
200 |
| 2 |
0.10 |
粉状 |
50 |
0.8 |
20 |
25 |
| 3 |
0.10 |
片状 |
50 |
1.0 |
20 |
125 |
| 4 |
0.10 |
片状 |
50 |
1.0 |
35 |
50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响,其规律是 。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是。
(忽略温度对反应速率的影响)
某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯

| 密度 (g/cm3) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是_____________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是()
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
30 |
120 |
280 |
350 |
370 |
反应速率最大的(填0~1、1~2、2~3、3~4、4~5min)时间段为。原因是。
②反应速率最小的时间段为,原因是
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率。
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他的做法可行的是(填相应字母);做法不可行的是(填相应字母),做法不可行的理由是。
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如图所示的实验装置,按要求回答问题: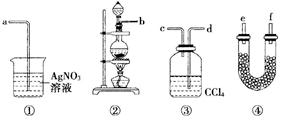
(1)请根据甲同学的意图,连接相应的装置,接口顺序:b接,接,接
。
(2)U形管中所盛试剂的化学式为。
(3)装置③中CCl4的作用是。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在之间(填装置序号)。瓶中可以放入。
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成,如果观察到现象,则证明制Cl2时有HCl挥发出来。
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 |
实验 |
实验现象 |
结论 |
| 实验Ⅱ |
将实验I中收集到的气体点燃 |
能安静燃烧、产生淡蓝色火焰 |
气体成分为 __ |
| 实验Ⅲ |
取实验I中的白色不溶物,洗涤, 加入足量 |
|
白色不溶物可能含有MgCO3 |
| 实验Ⅳ |
取实验I中的澄清液,向其中加入少量CaCl2稀溶液 |
产生白色沉淀 |
溶液中存在 ④离子 |
(3)为进一步确定实验I的产物,设计定量实验方案,如图所示: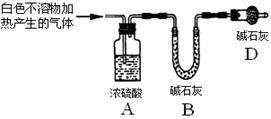
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式。
(4)用必要的语言文字叙述并结合方程式说明为什么碳酸氢钠溶液能和镁反应生成氢气?