某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为: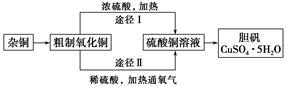
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
a.蒸发皿
b.石棉网
c.泥三角
d.表面皿
e.坩埚钳
f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是 (填字母编号)。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
短周期元素X、Y、Z在周期表中位置关系如图:(答题时,X、Y、Z用所对应的元素符号表示)
| X |
||
| Y |
||
| Z |
(1)x元素的单质分子式是_______,单质是_______晶体。
(2)自然界中存在一种仅含钙与Y两种元素的天然矿物,其电子式为_______,属于_______晶体。
(3)Z的氢化物和Y的氢化物沸点高低顺序是:,理由:。
(4)X、Y、Z三种元素中,电负性最大的是:。
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的化学方程式;
CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_________________________。
(2)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。
(3)金刚石的晶胞如图所示,已知六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,立方氮化硼晶体密度为ag/cm3,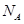 表示阿伏加德罗常数,则立方氮化硼晶胞体积为cm3。
表示阿伏加德罗常数,则立方氮化硼晶胞体积为cm3。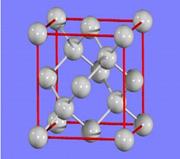
质子核磁共振谱(PMR)是研究有机物结构的重要方法之一。在研究的化合物分子中:所处环境完全相同的氢原子在PMR谱中出现同一种信号峰:如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。
请填写下列空白:
(1)化学式为C3H6O2的物质在PMR谱上观察到下列两种情况下氢原子给出的信号峰:第一种情况出现两个信号峰,第二种情况出现三个信号峰,由此可推断对应于这两种情况该常见有机物质结构式可能为:。
(2)测定CH3CH=CHCl时:能得到氢原子给出的信号峰6种:由此可推断该有机物一定存在两种不同的结构:其中一种结构式为:,另一种名称是。
(3)在C8H8Br2的同分异构体中,苯环上一硝化的产物只有一种的共有种。
烯烃A在一定条件下可以按下面的框图进行反应.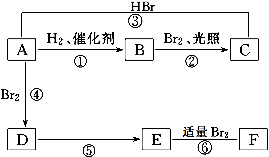
已知:D是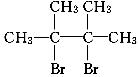 ,F分子中只有两个溴原子,并且接在不相邻的碳原子上。
,F分子中只有两个溴原子,并且接在不相邻的碳原子上。
请填空:
(1)C的结构简式是:___________,A在一定条件下可生成高分子G,G的结构简式是_________________________________ 。
(2)框图中属于取代反应的是:(填数字代号),属于加成反应的是(填数字代号).
(3)写出由D→E的化学方程式______________________________________;
写出由E→F的化学方程式______________________________________
下表为周期表的一部分,其中的编号代表对应的元素。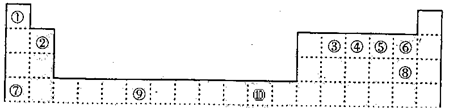
(1)写出上表中的元素⑩原子的外围电子排布式。
(2)元素⑦与⑧形成的化合物的晶体类型是。
(3)元素④的第一电离能(填“>”、“=”或“<”)元素⑤的第一电离能;元素④与元素①形成的X分子的空间构型为。X沸点高于同族其它元素与元素①形成的化合物的沸点,其原因是。
(4)第四周期所有元素的基态原子中,4p轨道半充满的是(请填元素符号,下同),3d轨道半充满的原子是,4s轨道半充满的是。
(5)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,其离子方程式为.