设NA为阿伏加德罗常数的值,下列说法中正确的是( )。
| A.等物质的量的CO2和NH3中所含的分子数均为NA |
| B.标准状况下,33.6 L SO3中含有的氧原子数是4.5NA |
| C.常温下,34.5 g NO2与N2O4的混合物中含有1.5NA个氧原子 |
| D.电解精炼铜时,每转移2NA个电子,阳极溶解64 g铜 |
9.下列事实不能用勒夏特列原理解释的是
| A.热的纯碱去污效果更好 |
| B.在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深 |
| C.实验室可用排饱和食盐水的方法收集氯气 |
| D.高压下有利于提高合成氨的产率 |
8.在2NO2(红棕色)  N2O4(无色)的可逆反应中,下列状态一定达到化学平衡状态的是
N2O4(无色)的可逆反应中,下列状态一定达到化学平衡状态的是
| A.N2O4和NO2的分子数比为1︰2 |
| B.N2O4和NO2的浓度相等 |
| C.单位时间内1 mol N2O4消耗的同时有2 mol NO2生成 |
| D.平衡体系的颜色不再改变 |
7.下列事实中,与电化学腐蚀无关的是
| A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 |
| B.为保护海轮的船壳,常在船壳上镶入锌块 |
| C.在空气中,金属银的表面生成一层黑色物质 |
| D.镀银铁制品,镀层部分受损后,露出的铁表面易被腐蚀 |
6.某化学反应的能量变化如下图所示。下列有关叙述正确的是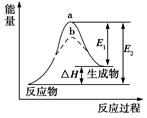
| A.该反应为放热反应 |
| B.E2可表示形成新的化学键所释放的能量 |
| C.该反应的反应热ΔH=E1-E2 |
| D.加入催化剂可同等程度的降低E1、E2 |
5.某温度下,满足下列条件的溶液肯定呈酸性的是
| A.加酚酞显无色的溶液 |
| B.含有H+的溶液 |
| C.pH<7的溶液 |
| D.CH3COOH和NH3·H2O混合液,当c(CH3COO-)> c(NH4+)时 |