下列化学反应的离子方程式书写正确的是( )。
| A.稀硝酸和过量铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| B.向硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4++OH-=NH3↑+H2O |
| C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| D.H2C2O4使酸性KMnO4溶液褪色:5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O |
将某些化学知识用数轴表示,具有直观形象、简明易记的优点。下列用数轴表示的化学知识中不正确的是
A.分散系的分类: |
B.AlCl3和NaOH溶液反应后产物中铝元素的存在形式: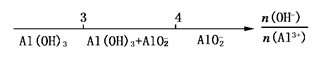 |
C.常温下甲基橙的变色范围: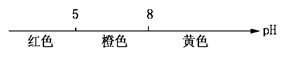 |
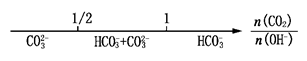
| D.CO2与NaOH溶液反应的产物: |
某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1,c(SO42-)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是
| A.0.5 L | B.1.625 L | C.1.8 L | D.2 L |
中药狼把草的成分之一M具有清炎杀菌作用,M的结构如图所示:下列叙述正确的是 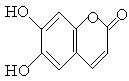
| A.M的相对分子质量是180 |
| B.1 mol M最多能与2molBr2发生反应 |
| C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D.1mol M与足量NaHCO3反应能生成2 mol CO2 |
把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为
| A.0.1(b-2a) mol·L-1 | B.10(2a-b) mol·L-1 |
| C.10(b-a) mol·L-1 | D.10(b-2a) mol·L-1 |
下列化学实验事实及其解释都正确的是
A.铝箔在酒精灯火焰上加热熔化但不 滴 滴 落,说明铝箔表面氧化铝膜熔点高于铝 落,说明铝箔表面氧化铝膜熔点高于铝 |
| B.将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4强 |
| C.FeCl3溶液可以腐蚀线路板上的Cu,说明Fe的金属活动性大于Cu |
D.将饱和氯水 滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有漂白性 滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有漂白性 |