通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
| 化学健 |
H-H |
Cl-Cl |
H-Cl |
| 键能 |
436 kJ·mol-1 |
243 kJ·mol-1 |
431 kJ·mol-1 |
则下列热化学方程式不正确的是( )
A.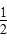 H2(g)+
H2(g)+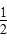 Cl2(g)=HCl(g)ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g)ΔH=-183 kJ·mol-1
C.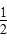 H2(g)+
H2(g)+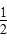 Cl2(g)=HCl(g)ΔH=91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=91.5 kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g)ΔH=183 kJ·mol-1
下列实验中不能出现沉淀现象的是
| A.NO2和SO2气体同时通入BaCl2溶液中 |
| B.SO2气体通入BaCl2溶液中 |
| C.SO2气体通入Ba(NO3)2溶液中 |
| D.SO2气体和过量NH3同时通入BaCl2溶液中 |
下表各组物质中,物质之间不可能实现如图所示转化的是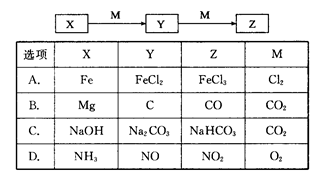
下列离子方程式的书写正确的是
| A.水玻璃中通入过量二氧化碳:Na2SiO3+CO2+H2O=2Na++CO32-+H2SiO3 |
| B.澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2=Ca2++2HCO3- |
| C.硅与氢氟酸的反应:Si+4H++4F-=SiF4↑+2H2↑ |
| D.二氧化硅溶于烧碱溶液中:SiO2+2OH-=SiO32-+H2O |
某同学用以下装置制备并检验Cl2的性质。下列说法正确的是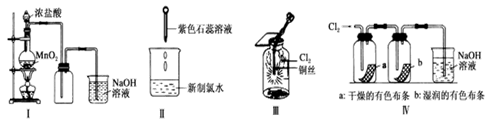
| A.Ⅰ图:若浓盐酸过量,则理论上MnO2可全部消耗完 |
| B.Ⅱ图:证明新制氯水只具有酸性 |
| C.Ⅲ图:产生了棕黄色的雾 |
| D.Ⅳ图:湿润的有色布条褪色,说明氯气具有漂白性 |
室温下,下列各组离子能大量共存的是
| A.稀硫酸中:K+、Mg2+、AlO2-、S2O32- |
| B.Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
| C.Kw/c(H+)=10-13溶液中:Fe3+、NH4+ 、Mg2+、SO42- |
| D.通人大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |