已知:A(s)+B(g) 2D(g) ΔH>0,该反应达到平衡后,下列条件的改变有利于平衡向正反应方向移动的是( )
2D(g) ΔH>0,该反应达到平衡后,下列条件的改变有利于平衡向正反应方向移动的是( )
| A.升高温度和减小压强 | B.降低温度和减小压强 |
| C.降低温度和增大压强 | D.升高温度和增大压强 |
将4 L N2和5 L H2充入密闭容器内,进行反应并达到平衡时,混和气体为8.5L,则其中含NH3的体积(气体体积均在相同状况下测定)是()。
| A.0.25 L | B.0.5 L |
| C.3.3 L | D.4.4 L |
在可逆反应中,混合物各种的浓度比一定等于各物质分子系数比的是()
| A.起始浓度 | B.转化浓度 |
| C.平衡浓度 | D.无法判断 |
在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应:2R(气)+5Q(气) 4X(气)+nY(气),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中n值是
4X(气)+nY(气),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中n值是
| A.2 | B.3 | C.4 | D.5 |
氙气和氟气按一定比例混合,在一定条件下可直接反应达到如下平衡
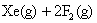

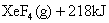
下列变化既能加快反应速率又能使平衡向正反应方向移动的是()
| A.升高温度 | B.加压 | C.减压 | D.适当降温 |
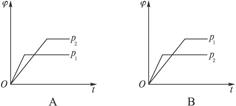
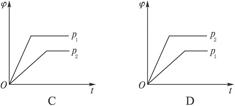
在一定温度不同压强(p1<p2)下,可逆反应2X(g) 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系如下图,正确的是()
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系如下图,正确的是()