合成氨反应的正反应是气体体积减小的放热反应。合成氨工业的生产流程如下: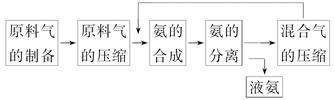
关于合成氨工业的说法中不正确的是( )
| A.混合气进行循环利用遵循绿色化学思想 |
| B.合成氨反应须在低温下进行 |
| C.对原料气进行压缩是为了增大原料气的转化率 |
| D.使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |
设NA为阿伏加德罗常数,下列有关叙述正确的是
| A.1 mol Cl2与足量金属铝反应,转移的电子数为3NA |
| B.标准状况下,11.2 L氦气中约含有NA个氦原子 |
| C.将NA个NH3分子溶于1 L水中得到1 mol·L-1的氨水 |
| D.常温下32 g含有少量臭氧的氧气中,共含有2 NA个氧原子(氧的相对原子质量:16) |
“纳米技术”广泛的应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是
| A.能全部通过半透膜 | B.能发生丁达尔现象 |
| C.一定能导电 | D.一定为悬浊液或乳浊液 |
将9 g铜和铁的混合物投入到100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法不正确的是
| A.原混合物中铜和铁各0.075 mol |
B.稀硝酸的物质的量浓度为2.0 mol·L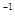 |
| C.第一次剩余4.8 g 金属为铜和铁 |
| D.向反应后的溶液中再加入该稀硝酸100 mL,又得到NO在标准状况下体积小于1.12 L |
已知在酸性溶液中的还原性强弱顺序为:SO2 > I > H2O2 > Fe
> H2O2 > Fe > Cl
> Cl ,下列反应不可能发生的是
,下列反应不可能发生的是
A.2I + Fe + Fe =I2 + Fe =I2 + Fe |
B.2Fe + SO2 + 2H2O=2Fe + SO2 + 2H2O=2Fe + SO + SO + 4H+ + 4H+ |
| C.SO2 + 2H2O + I2=H2SO4 + 2HI |
| D.H2O2 + H2SO4=SO2↑ + O2↑ + 2H2O |
下列实验的操作、现象、结论均正确的是
| 选项 |
操作 |
结论 |
| A |
用洁净的铂金丝沾取硫酸盐在酒精灯上灼烧,焰色为黄色 |
该硫酸盐一定含Na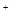 一定不含K 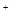 |
| B |
二氧化硫通入Ba(NO3)2溶液有白色沉淀生成,试管口出现浅红棕色气体 |
酸性条件下NO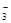 具有强氧化性 具有强氧化性 |
| C |
在淀粉的水解液中加入新制Cu(OH)2悬浊液加热,无红色沉淀 |
淀粉没有发生水解 |
| D |
某试样溶液中加入少量稀盐酸,有白色沉淀生成 |
试样中一定含有Ag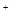 |