在密闭容器中进行的如下反应:2SO2(g)+O2(g) 2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
(1)反应的平衡常数为________。
(2)若将平衡时反应混合物的压强增大1倍,平衡将________(填“正向”“逆向”或“不”)移动。
(3)若平衡时反应混合物的压强减小1倍,平衡将________(填“正向”“逆向”或“不”)移动。
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,平衡将________(填“正向”“逆向”或“不”)移动。
.在20℃时一刚性容器内部有一不漏气且可左右滑动的活塞将容器分隔成左、右室两室。左室充入N2,右室充入H 2和O 2的混合气体,此时活塞正好停留离左端1/4处(如右图a)然后用电火花引燃右室气体,反应完毕恢复至原来温度,活塞恰好停留在容器中间(如右图b),水蒸气的体积可忽略,则反应前充入右室的混合气体中H 2和O 2的体积比为?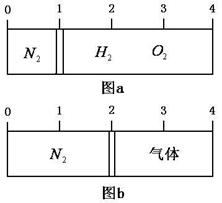
在干燥烧瓶中用向上排空气法收集氯化氢,由于空气不可能排净,所以瓶内气体对氢气的相对密度为17,将此瓶气体倒置于水槽中(氯化氢极易溶于水),烧瓶内液面上升的体积占烧瓶总体积的(填分数) ,假设溶质不向烧瓶外扩散,则所得盐酸中氯化氢的物质的量浓度为 mol/L(假设在标准状况下)
某状况下,2g二氧化碳气体的体积是 1120 mL,2g A 气体的体积是 770 mL,A的摩尔质量是__________。 某金属氯化物 MCl2 40.5 g含 0.6 mol Cl-,则该氯化物的摩尔质量为__________,金属M的相对原子质量为__________。
科学研究表明,由于大量使用氟利昂使南极上空的臭氧层出现空洞。臭氧的化学式为O3。在同温同压下,相同质量的O2和O3的物质的量比为,体积比为,氧原子数比为,密度比为
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为mol。
(2)该气体所含原子总数为个。
(3)该气体在标准状况下的体积为L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为。
(5)该气体溶于水后形成VL溶液,其溶质的物质的量浓度为mol·L-1。