某温度(t℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题: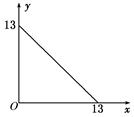
(1)此温度下,水的离子积KW为________,则该温度t__________25℃(填“>”“<”或“=”),pH=7的溶液显________(填“酸”“碱”或“中”)性。
(2)若将此温度(t℃)下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计)。试通过计算填写以下不同情况时两种溶液的体积比。
①若所得混合液为中性,则a∶b=______________________________________;
②若所得混合液的pH=2,则a∶b=____________________________________。
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液,并置于热水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液,并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
(l)制取氯气时,在烧瓶里加入一定量的二氧化锰。通过_______________________
(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_____________________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钾和次氯酸钠的条件。二者的差异是: ___________________________
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是_________________(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式_______________________ 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为____色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
|
| 然后溶液从无色逐渐变为____色 |
碱式碳酸镁有多种不同的组成,如 、
、 、
、 等。请你设计一个测定碱式碳酸镁组成的实验方案。包括
等。请你设计一个测定碱式碳酸镁组成的实验方案。包括
(1)测定原理
(2)测定实验的装置图
(3)操作步骤。
可使用的仪器、试剂和用品如下:
仪器:天平(附砝码)、大试管(附带有短玻璃管的橡皮塞)、酒精灯、洗气瓶、球形干燥管(附带有短玻璃管的橡皮塞)、铁架台、铁夹、角匙。
试剂:碱式碳酸镁(粉状)、浓硫酸、石灰水、无水氯化钙、碱石灰。
其他:火柴、棉花、短橡皮管、弹簧夹。
注意:①上述仪器和试剂只需应用其中的一部分。②仪器、试剂、用品的数量不限。
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是;
(2)指出实验步骤中存在的错误并改正:;
(3)硫酸钠不能放置在空气中冷却的原因是;
(4)步骤⑤的目的是;
(5)下面的情况有可能造成测试结果偏高的是(填序号)。
| A.试样中含有加热不挥发的杂质 |
| B.试样中含有加热易挥发的杂质 |
| C.测试前试样已有部分脱水 |
| D.实验前坩埚未完全干燥 |
E.晶体加热脱水不完全
F.加热时有晶体溅出
将蔗糖与稀硫酸共煮后,向溶液中加入新制 ,加热未见红色沉淀生成,其原因是____________________________________________。
,加热未见红色沉淀生成,其原因是____________________________________________。
BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态,②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构,③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋的元素符号分别是______和______。
(2)BGO晶体的化学式是___________。
(3)BGO晶体中所含铋氧化物的化学式是________。