在BaSO4饱和溶液中加入少量BaCl2溶液时产生沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
A.c(Ba2+)=c(SO )=(Ksp) )=(Ksp)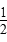 |
B.c(Ba2+)·c(SO )=Ksp,c(Ba2+)>c(SO )=Ksp,c(Ba2+)>c(SO ) ) |
C.c(Ba2+)·c(SO )>Ksp,c(Ba2+)=c(SO )>Ksp,c(Ba2+)=c(SO ) ) |
D.c(Ba2+)·c(SO )≠Ksp,c(Ba2+)<c(SO )≠Ksp,c(Ba2+)<c(SO ) ) |
用NA代表阿伏加德罗常数的数值,下列说法正确的是 ( )。
| A.标准状况下,22.4 L CHCl3中含有的氯原子的数目为3NA |
| B.7 g CnH2n中含有的氢原子数目为NA |
| C.18 g D2O中含有的质子数目为10NA |
| D.0.5 mol·L-1 Na2CO3溶液中含有的CO32-的数目为0.5NA |
下列每组分别给出了两个量,其中可以求出物质的量的有( )。
| ① |
② |
③ |
④ |
⑤ |
| 物质所含的微粒数 |
固体体积 |
溶液的质量分数 |
标准状况下气体的摩尔体积 |
非标准状况下某物质的质量 |
| 阿伏加德罗常数 |
固体密度 |
溶液体积 |
标准状况下气体的体积 |
物质的摩尔质量 |
A.①②⑤B.②③④ C.①④⑤D.①③④
在下列条件下,两种气体的分子数一定相等的是 ( )。
| A.同密度、同压强的N2和C2H4 |
| B.同温度、同体积的O2和N2 |
| C.同体积、同密度的C2H4和CO |
| D.同压强、同体积的O2和N2 |
下列有关气体体积的叙述中,正确的是 ( )。
| A.在一定的温度和压强下,各种气态物质体积的大小由气体分子的大小决定 |
| B.在一定的温度和压强下,各种气态物质体积的大小由物质的量的多少决定 |
| C.不同的气体,若体积不同,则它们所含的分子数一定不同 |
| D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L |
三聚氰胺又名蛋白精[分子式:C3N3(NH2)3,相对分子质量:126]是一种低毒性化工产品,婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺的下列说法正确的是 ( )。
| A.2.52 g三聚氰胺含氮原子数目为0.12NA |
| B.标准状况下1 mol的三聚氰胺的体积为22.4 L |
| C.三聚氰胺含氮量约为10% |
| D.三聚氰胺的摩尔质量为126 |