臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是________和________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。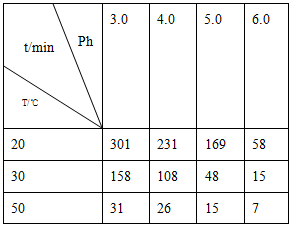
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40℃、pH=3.0 b.10℃、pH=4.0
c.30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为________(填“A”或“B”),其电极反应式为_______________________。
②若C处通入O2,则A极的电极反应式为________。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为________(忽略O3的分解)。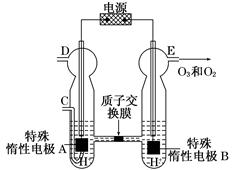
能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌。而甲醇是未来重要的绿色能源之一。
(1)已知:在25 ℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。
请写出甲醇燃烧的热化学方程式。
(2)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇: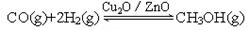 甲醇的物质的量与反应温度的关系如右图所示:
甲醇的物质的量与反应温度的关系如右图所示: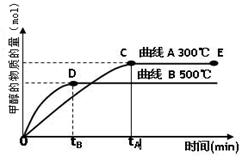 、
、
①合成甲醇反应的△H______0。(填“>”、“<”或“=”)
②其它条件不变,将E点的容积压缩到原来的1/2,正反应速率加快,逆反应速率____________。(填“加快”、“减慢”、“不变”),重新平衡时c(CH3OH)/c(CO)_________。(填“增大”、“减小”或“不变”)
③230℃时,平衡常数K=1。若其它条件不变,将温度升高到450℃时,达到平衡时,K1(填“>、< 或 = ”)
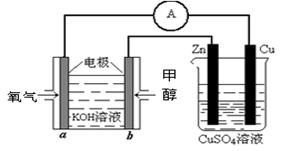
(3)利用甲醇燃料电池设计如右图所示的装置:则该装置中Zn极为极;写出a极的电极反应式
。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)右图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式;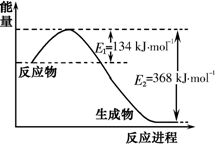
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K/(mol·L–1)2 |
4.1×106 |
K1 |
K2 |
… |
完成下列问题:
①比较K1、K2的大小:K1K2(填“>”、“=”或“<”);
②判断该反应达到化学平衡状态的依据是(填序号);
A.2υ(H2)(正=3υ(NH3)(逆)B.2υ(N2)(正=υ(H2)(逆)
C.容器内压强保持不变D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。(肼的分子式为N2H4)
①写出盐酸肼第一步水解反应的离子方程式;
②盐酸肼水溶液中离子浓度关系正确的是(填序号)。
A.c(Cl–)>c(N2H62+)>c(H+)>c(OH–)
B.c(Cl–)>c( [N2H5·H2O+])>c(H+)>c(OH–)
C.2 c(N2H62+)+ c ([N2H5·H2O +])+c(H+)=c(OH–)
D.c(N2H62+)>c(Cl–)>c(H+)>c(OH–)
根据下列化合物:①NaCl②NaOH③HCl④NH4Cl⑤CH3COONa⑥CH3COOH⑦NH3·H2O⑧H2O,回答下列问题。
(1)NH4Cl溶液显_______性,用离子方程式表示原因。其溶液中离子浓度大小顺序为。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH–)=__________,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_____________。
(3)已知纯水中存在如下平衡:H2O+H2O H3O++OH– ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是____________(填字母序号)。
H3O++OH– ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是____________(填字母序号)。
| A.向水中加入NaHSO4固体 | B.向水中加Na2CO3固体 |
| C.加热至100℃[其中c(H+)=1×10–6 mol·L–1] | D.向水中加入(NH4)2SO4固体 |
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为。
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。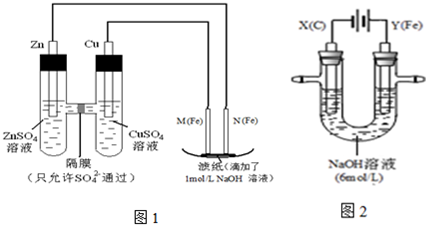
请回答:
I.用图1所示装置进行第一组实验。
(1)N极发生反应的电极反应式为。
(2)实验过程中,SO42-(填“从左向右”、“从右向左”或“不”)移动;
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X极区溶液的pH(填“增大” 、“减小”或“不变”)。
(4)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和4OH- - 4e-=2H2O + O2↑, 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn=Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为。
(6)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:__________________________。
下图是一个电化学过程的示意图。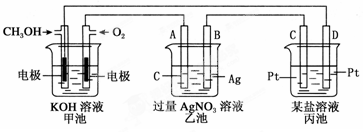
请回答下列问题:
(1)图中乙池是 (填“原电池”“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”“负极”“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:。
(4)乙池中反应的化学方程式为,当乙池中B(Ag)极质量增加5.4 g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中电极(填“C”或“D”)析出1.6 g某金属,则丙池中的某盐溶液可能是________。
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |