沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和H2O(l)时,放出445 kJ热量,则下列热化学方程式中正确的是( )
| A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)ΔH=+890 kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=+890 kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890 kJ/mol |
D.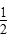 CH4(g)+O2(g)= CH4(g)+O2(g)=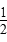 CO2(g)+H2O(l)ΔH=-890 kJ/mol CO2(g)+H2O(l)ΔH=-890 kJ/mol |
将2mol PCl3和1mol Cl2充人一容积不变的密闭容器中,在一定条件下反应:
PCl3 (g) + Cl2(g) 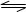 PCl 5 (g)达平衡时,PC15为0.4mol。此时若移走1 molPCl3和0.5molCl2,在相同温度下达平衡时PCl5的物质的量是 ( )
PCl 5 (g)达平衡时,PC15为0.4mol。此时若移走1 molPCl3和0.5molCl2,在相同温度下达平衡时PCl5的物质的量是 ( )
| A.0.4 mol | B.小于0.2 mol |
| C.0.2 mol | D.大于0.2 m01而小于0.4 mol |
在密闭容器中发生如下反应: aX(g) + bY(g)  cZ(g) +d W(g)。反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是 ( )
cZ(g) +d W(g)。反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是 ( )
| A.平衡向逆反应方向移动 | B.a + b < c + d |
| C.Z的体积分数增加 | D.X的转化率下降 |
温度相同,向甲、乙两体积相同的密闭容器中,各通入2mol SO2和1 mol O2发生反应;
2SO2(g)+O2(g)  2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率。下列判断正确的是 ( )
2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率。下列判断正确的是 ( )
| A.甲保持压强不变,乙保持体积不变 |
| B.甲保持体积不变,乙保持压强不变 |
| C.混合气体密度甲小于乙 |
| D.混合气体的平均相对分子质量甲小于乙 |
在容积为4 L的刚性密闭容器中.进行可逆反应:X (g) + 2Y(g) 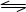 2Z(g)并达到平衡在此过程中以Y的浓度改变表示的反应速率γ(正)、γ(逆)与时间t的关系如图示,则图中阴影部分的面积表示( )
2Z(g)并达到平衡在此过程中以Y的浓度改变表示的反应速率γ(正)、γ(逆)与时间t的关系如图示,则图中阴影部分的面积表示( )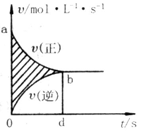
| A.X的浓度的变化 | B.Y的浓度的变化 |
| C.Z的浓度的变化 | D.Y的物质的量的减少 |
可逆反应:3R(气) 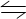 3M(?)十N(?) ( 吸热反应 ),随着温度的升高,气体平均相对分子质量有变小的趋势。则下列判断中正确的是( )
3M(?)十N(?) ( 吸热反应 ),随着温度的升高,气体平均相对分子质量有变小的趋势。则下列判断中正确的是( )
| A.M和N可能都是固体 | B.若N为固体.则M一定是气体 |
| C.M和N一定都是气体 | D.若M为固体.则N一定是气体 |