在容积不变的密闭容器中存在如下反应:2A(g)+B(g) 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
| A.图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响 |
| B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 |
| D.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
在一定量的Na2S(aq)中,慢慢通入一定量Cl2,图示变化关系正确的是
取一定量FeO和Fe2O3的混合物,在H2流中加热充分反应。冷却,称得剩余固体比原混合物质量减轻1.200g。若将同量的该混合物与盐酸反应完全,至少需1mol/L盐酸的体积为
| A.37.5mL | B.75mL | C.150mL | D.300mL |
实验室制取氯气并回收氯化锰,能达到该实验目的的装置是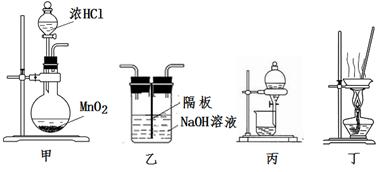
| A.用装置甲制取氯气 | B.用装置丙分离二氧化锰和氯化锰溶液 |
| C.用装置乙吸收制取氯气的尾气 | D.用装置丁蒸干氯化锰溶液制 MnCl2·4H2O |
除杂和配制试剂是中学化学中常见的实验。对实验方法描述正确的是
| A.用蒸发结晶法除去KNO3中少量的NaCl |
| B.用加入NaOH(aq)并蒸馏的方法除去乙醛中少量的乙酸 |
| C.准确称取14.800g Ca(OH)2,配制100mL 2.0 mol/L的Ca(OH)2溶液 |
| D.在2mL10%的CuSO4(aq)中滴入3滴 2%的NaOH(aq),配制检验醛基的试剂 |
不能用平衡移动原理解释的事实是
| A.压缩盛有I2和H2混合气体的针筒,气体颜色变深 |
| B.pH均为4的盐酸和NH4Cl(aq)中水的电离度后者大 |
| C.打开汽水瓶盖,即有大量气泡逸出 |
| D.用排饱和食盐水的方法收集氯气 |