W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是
| A.对应简单离子半径:X>W |
| B.对应气态氢化物的稳定性Y>Z |
| C.化合物XZW既含离子键,又含共价键 |
| D.Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应 |
下列有关物质性质的应用正确的是( )
| A.液氨汽化时要吸收大量的热,可用作制冷剂 |
| B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| C.生石灰能与水反应,可用来干燥氯气 |
| D.氯化铝是一种电解质,可用于电解法制铝 |
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )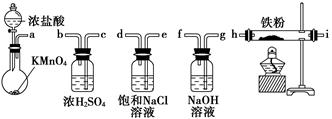
| A.a-b-c-d-e-f-g-h |
| B.a-e-d-c-b-h-i-g |
| C.a-d-e-c-b-h-i-g |
| D.a-c-b-d-e-h-i-f |
下列措施不合理的是( )
| A.用SO2漂白纸浆和草帽辫 |
| B.用硫酸清洗锅炉中的水垢 |
| C.高温下用焦炭还原SiO2制取粗硅 |
| D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
下列说法不正确的是( )
| A.多孔碳可用作氢氧燃料电池的电极材料 |
| B.pH计不能用于酸碱中和滴定终点的判断 |
| C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素 |
D.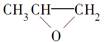 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物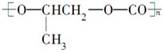 ,该反应符合绿色化学原则 ,该反应符合绿色化学原则 |
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )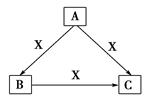
A.若X为Cl2,则C可为FeCl3
B.若X为KOH溶液,则A可为AlCl3
C.若X为O2,则A可为硫化氢
D.若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2