在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
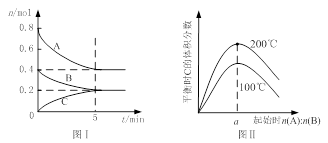
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
在合成氨时,可以提高H2转化率的措施:()
| A.延长反应时间 | B.充入过量H2 |
| C.充入过量N2 | D.升高温度 |
将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是:()
| A.KCl | B.Mg(OH)2 | C.Na2CO3 | D.MgSO4 |
将Mg、Cu组成的2.64g混合物投入适量稀稍酸中恰好完全反应,并收集还原产物气体NO(还原产物只有一种)。然后向反应后的溶液中加入一定浓度的氢氧化钠溶液,使金属恰好沉淀完全,此时生成沉淀的质量为4.68g,则反应过程中收集到NO气体(标况下)体积为()
| A.8.96L | B.4.48L | C.0.896L | D.0.448L |
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi  LixV2O5。下列说法中,正确的是()
LixV2O5。下列说法中,正确的是()
| A.锂在放电时做正极材料,充电时为阳极材料 |
| B.电池在放电时,Li+向负极移动 |
| C.该电池充电时阳极的反应为:LixV2O5 -xe-=V2O5 + xLi+ |
| D.V2O5只是锂发生反应的载体,不参与电池反应 |
以下有关实验原理及结论正确的是()
| A.XCl3的溶液能与铜片发生反应,则铜的金属性一定比X强 |
| B.金属X能与NaOH溶液反应放出H2,但金属Y不能,则Y的金属性一定比X弱 |
| C.非金属X能将Fe氧化到+3价,但非金属Y不能,则Y的氧化性一定比X强 |
| D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32― + 6H+ + 2MnO4―= 5SO4 2― + 2Mn2+ +3H2O |