某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
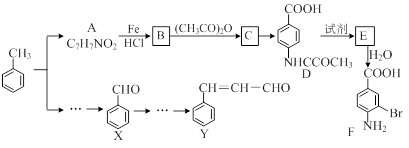
已知:①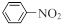

②2CH3CHO  CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO  CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
⑴下列有关F的说法正确的是 。
| A.分子式是C7H7NO2Br |
| B.能形成内盐 |
| C.能发生取代反应和缩聚反应 |
| D.1 mol的 F最多可以和2 mol NaOH反应 |
⑵C→ D的反应类型是 。 ⑶B→C的化学方程式是 。
在合成F的过程中,B→C步骤不能省略,理由是 。
⑷D→E反应所需的试剂是 。
⑸写出同时符合下列条件的A的同分异构体的结构简式(写出3个)。
①苯环上只有两种不同化学环境的氢原子 ②分子中含有 -CHO
; ;
⑹以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO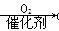 CH3COOH
CH3COOH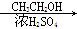 CH3COOCH2CH3
CH3COOCH2CH3
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 |
K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
Cl-CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为:
(4)甲同学最终确定原溶液中所含阳离子是,阴离子是(写离子符号)。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为g。
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2.。
(1) 在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是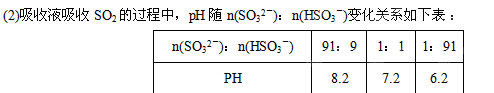
①由上表判断NaHSO3溶液显性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+) = 2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性。试用化学方程式分别表示盐碱地产生碱性的原因:,及用石膏降低其碱性的反应原理:。
请判断下列说法是否正确(填“对”或“错”)。
(1)碱性锌锰电池是一次电池,铅蓄电池是二次电池。
(2)随着温度的升高,纯水的pH增大。
(3)冰醋酸、纯碱、小苏打分别属于酸、碱、盐。
(4)镀锌铁制品破损后,镀层仍能保护铁制品。
(5)醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度。
(6)25 ℃时,某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐。
(7)用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓
(8)pH=2与pH=1的硝酸中c(H+)之比为1:10
(9)Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
(10)向含有硫酸钙的水垢中加入碳酸钠溶液,沉淀的转化可表示为:
CaSO4(s)  SO42— + Ca2+
SO42— + Ca2+
CO32— CaCO3(s)
CaCO3(s)
常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于。
(1)酸性溶液c(H+)(填“>”、“<”或“=”,下同)c(OH-),pH 7。
人的胃液中含有盐酸,经测定某人胃液的pH为2,则其中的c(H+)=mol/L。
食醋常用于食品调味,其主要成分为醋酸,醋酸的电离方程式为。
(2)室温下,pH均为3的盐酸和醋酸溶液,下列各项中相等的是(填序号)。
①溶液中c(H+)②酸的物质的量浓度③完全中和时,消耗NaOH的质量
(3)在①NaCl、②CH3COONa、③NH4Cl三种盐溶液中,常温下呈酸性的是(填序号,下同)), 呈中性的是, 呈碱性的是。
(4)氯化铁水解的离子方程式为,配制氯化铁溶液时滴加少量盐酸的作用是。