设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
| B.pH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA |
| C.78 g苯中含有碳碳双键的数目为3NA |
| D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.2NA |
一定条件下水分解生成氢气和氧气,有关物质和能量的转化关系如图所示,下列判断正确的是
| A.△H1 > △H2 |
| B.△H2 < △H3 |
| C.△H1= △H2+ △H3 |
| D.△H1 + △H3> △H2 |
下列事实不能用勒夏特列原理解释的是
| A.将氯化铁晶体溶解于浓盐酸中配制氯化铁溶液 |
| B.温度升高,水的电离程度增大 |
| C.氯水中加入碳酸钙,漂白性增强 |
D.反应H2(g)+I2(g) 2HI(g)达平衡后,缩小反应容器体积,混合气体颜色变深 2HI(g)达平衡后,缩小反应容器体积,混合气体颜色变深 |
对于可逆反应:A(g)+2B(g) 2C(g) △H<0,下列图像正确的是
2C(g) △H<0,下列图像正确的是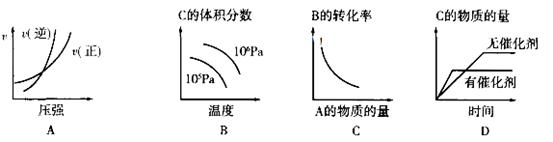
以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Au等杂质)的电解精炼,下列说法正确的是
| A.利用阳极泥可回收Ag、Au等金属 |
| B.阳极减少的质量一定等于阴极增加的质量 |
| C.精炼过程中,CuSO4溶液的浓度不发生改变 |
| D.因部分电能转化为热能,精炼时通过的电量与阴极铜的析出量无确定关系 |
工业上合成氨的反应为N2(g)+3H2(g) 2NH3(g)△H<0,在其他条件不变的情况下,下列说法正确的是
2NH3(g)△H<0,在其他条件不变的情况下,下列说法正确的是
| A.加入催化剂,逆反应速率不变 |
| B.增大反应体系的压强,正反应速率一定增大 |
| C.升高温度,反应速率加快,反应放出的热量减小 |
| D.若在原电池中进行,反应放出的热量不变 |