为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+ PbO2(s)+2H2SO4(aq)= 2PbSO4(s)+ 2H2O(l)
电解池:2Al + 3H2O  Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
| |
原电池 |
电解池 |
| A |
H+移向Pb电极 |
H+移向Pb电极 |
| B |
每消耗3molPb |
生成2molAl2O3 |
| C |
正极:PbO2+4H++2e-=Pb2++2H2O |
阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D |
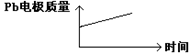 |
 |
将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是()
| A.硫酸 | B.氯水 | C.硝酸锌 | D.氯化铜 |
Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是()
| A.氯化物 | B.硫酸盐 |
| C.硝酸盐 | D.磷酸盐 |
实验室不需用棕色试剂瓶保存的试剂是()
| A.浓硝酸 | B.硝酸银 | C.氯水 | D.浓硫酸 |
下列关于浓HNO3与浓H2SO4的叙述正确的是()
| A.常温下都可用铁制容器贮存 | B.常温下都能与铜较快反应 |
| C.露置于空气中,溶液质量均减轻 | D.露置于空气中,溶液浓度均降低 |
.将38.4×10-3 g铜与足量的浓硝酸反应,铜全部反应后,共收集到气体22.4 mL(标准状况下),反应消耗的HNO3的物质的量是( )
| A.1.0×10-3 mol | B.1.6×10-3 mol |
| C.2.2×10-3 mol | D.1.8×10-3 mol |