已知一定温度下,有下列难溶电解质的相关数据
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| KSP/250C |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
A.向该混合溶液中加过量铁粉,能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C.该混合溶液中c(SO42-):[c(Cu2+)+ c(Fe2+)+ c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氯水,并调pH至3~4后过滤,能得到纯净的CuSO4溶液
X、Y、Z为三种气体。把amolX和bmolY充入一密闭容器中。发生反应X+2y=2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
| A.[(a+b)/5]×100% |
| B.[2(a+b)/5b]×100% |
| C.[2(a+b)/5]×100% |
| D.[(a+b)/5a]×100% |
反应2X(气)+Y(气)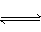 2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( )
2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( ) 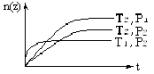
| A.T1<T2,P1<P2 |
| B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 |
| D.T1>T2,P1<P2 |
在一密闭容器中,反应aA(气)=bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%则( )
| A.平衡向正反应方向移动了 |
| B.物质A的转化率减少了 |
| C.物质B的质量分数增加了 |
| D.a>b |
可逆反应:3A(气)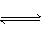 3B(?)+C(?)(正反应为吸热反应)随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?)(正反应为吸热反应)随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
| A.B和C可能都是固体 |
| B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 |
| D.B和C可能都是气体 |
设C+CO2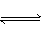 2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2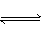 NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为( )
NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为( )
| A.同时增大 |
| B.同时减小 |
| C.发v1增大,v2减小 |
| D.v1减小,v2增大 |