已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用右图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体V mL。下列说法正确的是( )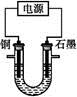
| A.铜电极连接电源正极 |
| B.黑色粉末X是铁粉 |
C.铜的相对原子质量的计算式是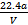 |
D.石墨电极上发生的反应是4OH--4e- O2↑+2H2O O2↑+2H2O |
已知反应X + Y =" M" + N为放热反应,对该反应的下列说法中正确的是
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因该反应为放热反应,故不必加热就可发生 |
把1.0 g含脉石(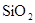 )的黄铁矿样品在氧气流中灼烧,反应完全后得0.78g残渣,则此黄铁矿的纯度是()
)的黄铁矿样品在氧气流中灼烧,反应完全后得0.78g残渣,则此黄铁矿的纯度是()
| A.33% | B.66% | C.78% | D.88% |
接触法制硫酸中,进入接触室的气体必须净化、干燥,其主要原因是()
| A.防止催化剂中毒 | B.提高反应效率 |
| C.提高SO2转化率 | D.防止环境污染 |
工业上生产硫酸,回收尾气中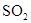 气体,选用的试剂是()
气体,选用的试剂是()
A.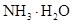 |
B.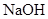 |
C.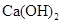 |
D.浓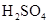 |
在工业生产硫酸中,在吸收塔内用来吸收三氧化硫的是()
A. |
B.稀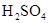 |
C.浓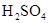 |
D.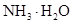 |