(1)将等物质的量的KI和CuCl2溶于水,用惰性电极电解,该电解反应可分为________个阶段(表格不一定填满,若不够还可以自行添加)。
| 阶段 |
相当于电解什么溶液 |
离子方程式 |
| ① |
|
|
| ② |
|
|
| ③ |
|
|
| ④ |
|
|
| ⑤ |
|
|
(2)画出过程中溶液pH随时间变化的曲线(假定生成的Cl2全部逸出)。
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
AB C D
(2)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式。
下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: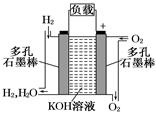
(1)图中通过负载的电子流动方向______(填“向左”或“向右”).
(2)写出氢氧燃料电池工作时电极反应方程式和总反应方程式.
负极:___________________________,总反应:________________________.
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
阅读下面的信息,推断元素及有关物质,按要求回答:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是(填序号)。
A氢 B. 碳 C. 氧 D. 硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,所生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素?(填可能或不可能)。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)该白色沉淀物的化学式为。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成该白色沉淀物的离子方程式为。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为。
(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_____________________________,发生反应(填氧化或还原);电子从
经外电路到(填锌或铜),溶液中H+ 向移动(填正极或负极),放电一段时间后,正极区pH值(填变大、变小或不变)。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表。
负极电极反应式为_________________,
总反应的离子方程式为______。
(3)将铁片和石墨电极用导线连接后插入氯化钠溶液并露置在空气中,也有电流通过电流表,请写出负极电极反应式____________,正极电极反应式为_____________。