反应N2O4(g)  2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 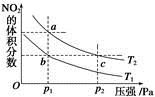
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深、c浅 |
| C.a、b两点气体的平均相对分子质量:a>b |
| D.b、c两点化学平衡常数:b<c |
已知氧化还原反应反应 K2Cr2O7 + 14HCl ="=" 2KCl + 2CrCl3 + 3Cl2+ 7H2O
="=" 2KCl + 2CrCl3 + 3Cl2+ 7H2O
关于该反应的说法中正确的组合是
①氧化剂是K2Cr2O7 ②还原性:Cl->Cr3+
③每生成1mol Cl2,电子转移为6mol ④CrCl3是氧化产物
| A.①② | B.①②④ | C.①③④ | D.①③ |
有一块铁的“氧化物”样品,用140mL 5.0mol·L-1 盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
同温同压下,等容积的两容器内分别充满14N18O和13C18O气体。下列说法正确的是
| A.所含分子数和质量均不相同 | B.含有相同的分子数和电子数 |
| C.含有相同的质子数和中子数 | D.含有相同数目的中子、原子和分子 |
FeCl3溶液、Fe(OH)3胶体共同具备的性质是
| A.都呈透明的红褐色 |
| B.分散质颗粒直径相同 |
| C.都比较稳定,密封保存一段时间都不会产生沉淀 |
| D.都能产生丁达尔现象 |
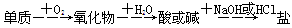 ,能实现上述物质间直接转化的元素
,能实现上述物质间直接转化的元素
| A.硅 | B.硫 | C.铜 | D.铁 |