常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
则下列说法不正确的是
| A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4 |
| B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+=CuS↓+H+ |
| C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理 |
D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2 +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
10mL6mol/L H2SO4溶液与过量锌粉反应,在一定温度下,为了使产生H2的速率减缓,但又不影响生成氢气的总质量,可向反应物中加入
| A.NaNO3 溶液 | B.CuSO4或石墨 | C.Na2SO4溶液 | D.NaHSO3 或CuO |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
| A.a>b | B.a=b | C.a<b | D.无法确定 |
已知
(1)H2O(g) ="=" H2O(l)ΔH1=-Q1 kJ·mol-1
(2)CH3OH(g) ="=" CH3OH(l)△H2=-Q2 kJ·mol-1
(3)2CH3OH(g) +3O2(g) ="=" 2CO2(g)+4H2O(g)△H3=-Q3 kJ·mol-1
(Q1、Q2、Q3均大于0)若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)()
| A.Q1+ Q2 + Q3 | B.0.5 Q3-Q2+2Q1 |
| C.0.5 Q3+ Q2-2Q1 | D.0.5(Q1+Q2+Q3) |
将1 mol SO2和1 mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g) 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
| A.等于0.3 mol | B.等于0.15 mol |
| C.小于0.15 mol | D.大于0.15 mol,小于0.3 mol |
在一定固定的密闭容器中,放入3mol X(g)和2mol Y(g),在一定条件下发生反应: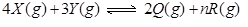 ,达平衡后,容器内温度不变,平衡后压强比原来增加5%,X的浓度减小,则该反应方程式中的n值是()
,达平衡后,容器内温度不变,平衡后压强比原来增加5%,X的浓度减小,则该反应方程式中的n值是()
| A.3 | B.4 | C.5 | D.6 |