在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.1 L 0.1 mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液中:c(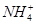 )+c(Fe2+)+c(H+)=c(OH-)+c(
)+c(Fe2+)+c(H+)=c(OH-)+c( )
)
B.0.1 mol·L-1 NH4HS溶液中:c(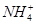 )=c(HS-)+c(H2S)+c(S2-)
)=c(HS-)+c(H2S)+c(S2-)
C.0.1 mol·L-1 pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c( )=c(
)=c( )+3c(H2CO3)+2c(H+)
)+3c(H2CO3)+2c(H+)
化学与生活息息相关,下列做法不正确的是
| A.将废旧电池集中统一处理以防止重金属污染 |
| B.对垃圾进行分类投放、分类回收、分类处理与再利用 |
| C.用甲醛的水溶液浸泡海产品,防腐保鲜 |
| D.按食品卫生标准严格控制食品添加剂(防腐剂等)的用量 |
以下实验操作正确的是
| A.用量筒量取5.0 mL浓硫酸并直接在量筒中稀释 |
| B.用嘴吹灭燃着的酒精灯火焰 |
| C.称量NaOH固体时,将药品直接放在托盘上 |
| D.给烧瓶里的液体加热时,垫上石棉网 |
下列做法不能达到实验目的的是
| A.用灼烧的方法鉴别羊毛和纯棉织品 | B.用氯化钡溶液鉴别盐酸和稀硫酸 |
| C.观察气体颜色区别氮气和氧气 | D.利用丁达尔效应区别溶液和胶体 |
下列颜色变化与化学反应无关的是
| A.无色NO气体遇空气变为红棕色 |
| B.紫色石蕊试液滴入盐酸中,溶液变红 |
| C.往酸性KMnO4溶液中通入乙烯,溶液褪色 |
| D.往红墨水中投入活性碳,红色褪去 |
某些装饰材料会缓慢释放出某种化学物质,影响健康,这种化学物质可能是
| A.甲醛 | B.O2 | C.N2 | D.CO2 |