已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
反应②CO(g)+1/2O2(g) CO2(g) ΔH=bkJ·mol-1;
CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(2)反应①为 (选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2
C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。 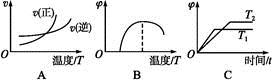
(5)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
已知某反应在不同条件下的反应历程可以表示成下图,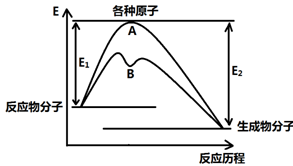
E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
(1)据图判断该反应是(填“吸”或“放”)热反应,如该反应可逆,则其达到平衡后,其他条件不变,升高温度,反应物的转化率(填“增大”、“减小”或“不变”),其中B历程表明此反应改变的条件为(填字母)。
| A.增大反应物的浓度 | B.降低温度 | C.增大压强 | D.使用催化剂 |
(2)下表给出了一些化学键的键能:
| 化学键 |
H—H |
Cl—Cl |
O=O |
O—H |
H—Cl |
| 键能(kJ·mol-1) |
436 |
247 |
x |
463 |
431 |
①若图中表示反应H2(g) +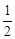 O2(g)=H2O(g) ΔH=" -" 241.8 kJ·mol-1,则x=kJ·mol-1(保留一位小数)。
O2(g)=H2O(g) ΔH=" -" 241.8 kJ·mol-1,则x=kJ·mol-1(保留一位小数)。
②催化剂、加热条件下可用氧气与氯化氢气体反应置换出氯气,同时生成另一种气态化合物,利用上表数据写出该热化学方程式,当该反应中有1 mol电子发生转移时,图像中历程A的E1=kJ(保留一位小数)。
X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):
请回答:
⑴W的化学式是____________________。
⑵X与Y在溶液中反应的离子方程式是_______________________________。
⑶①将4.48 L(已折算为标准状况)W通入100 mL3 mol/L的Y的水溶液后,溶液中的溶质是________。
②自然界中存在X、Z和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测
得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为g。
已知有以下物质相互转化: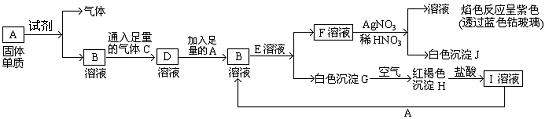
(1)A转化为B及气体这步反应中应加入的试剂是(填化学式);
(2)写出B的化学式,F的化学式;
(3)写出由G转变成H的化学方程式;
(4)写出检验I溶液中阳离子的离子方程式;
向I溶液中加入A的有关离子反应方程式是。
欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加蒸馏水至刻度线 |
| D.洗净所用仪器 |
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好.
(4)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_________________________。
(5)在配制过程中,①某学生观察定容时仰视液面,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”下同)。②未经冷却趁热将溶液注入容量瓶中,________。③摇匀后发现液面低于刻度线再加水,________。④容量瓶中原有少量蒸馏水,________。
怎样用化学方法除去下列物质中混有的少量杂质(用有关反应的离子方程式)。
(1)铜粉中混有铁粉
(2)NaHCO3溶液中混有Na2CO3
(3)FeCl2溶液中混有CuCl2