将4 mol A和2 mol B放入2 L密闭容器中发生反应:2A (g)+B(g)2C(g);ΔH<0,4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是( )
A.4 s内,v(B)=0.075 mol/(L·s)
B.4 s后平衡状态下,c(A)∶c(C)=2∶1
C.达到平衡状态时,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
海洋中有丰富的食品、矿产、能源、药物和水产资源,对今后世界经济发展有着决定性作用。下列有关说法正确的是 ( )。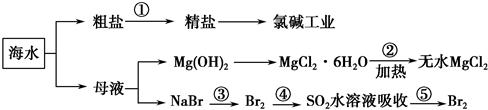
| A.整个过程可在实验室中模拟进行 |
| B.工段②是风化过程 |
| C.在工段③④⑤中溴元素均被氧化 |
| D.工段①中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
下图中正确的是 ( )。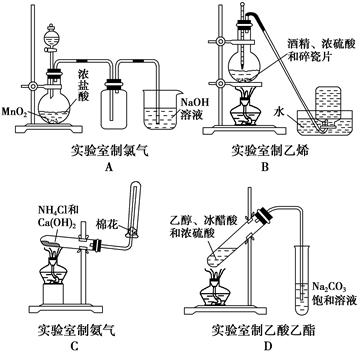
实验是化学研究的基础,下列各图所示的实验方法、装置或操作正确的是( )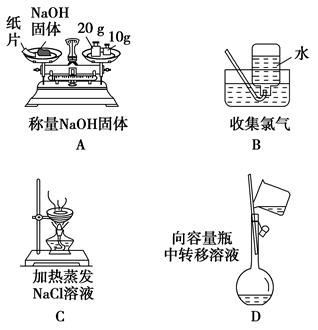
为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是 ( )。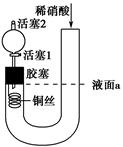
| A.关闭活塞1,加入稀硝酸至液面a处 |
| B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率 |
| C.通过关闭或开启活塞1可以控制反应的进行 |
| D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO |
下列实验操作正确的是 ( )。
| A.中和滴定实验时,用待测液润洗锥形瓶 |
| B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶 |
| C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
| D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |